איידס: האם מציאת חיסון לנגיף אפשרית?
שיטות עתידיות וגילויים מהשנים האחרונות, מעוררים תקווה כי ניתן יהיה לפתח בעתיד חיסון יעיל ל-HIV. אך כדי לעשות זאת, פיתוח החיסונים יצטרך להישען על ידע מעמיק יותר של מנגנוני ההתפתחות של הנגיף לאורך זמן, מנגנוני תגובת מערכת החיסון אליו והריפוי. תמונת מצב
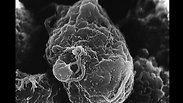
נגיף ה-HIV, הגורם למחלת האיידס - AIDS, הופיע לראשונה ב-1981, אחרי שעבר מקופי שימפנזה לבני אדם באמצע המאה ה-20.
נכון לשנת 2011 חיים בעולם כ-34 מיליון בני אדם נשאי הנגיף, 23.5 מיליון מתוכם חיים באפריקה שמדרום לסהרה, 4.8 מיליון חיים באסיה, 1.4 מיליון באמריקה הלטינית, 1.4 מיליון במזרח אירופה, וכ- 2.3 מיליון חיים באמריקה הצפונית ובמרכז אירופה.
- עוד כתבות בעמוד הפייסבוק של ynet
על אף שבשנת 2011 נדבקו בנגיף 700,000 איש פחות מאשר בשנת 2010, מספר הנדבקים החדשים ב-2011 עדיין גבוה ועומד על 2.5 מיליון בני אדם. בשש השנים האחרונות קטנה בשליש התמותה מאיידס במדינות אפריקה, אך באותה שנה עדיין מתו מהמחלה ברחבי העולם 1.7 מיליון בני אדם.
נתונים פחות מעודדים מגיעים דווקא מהמזרח התיכון ומצפון אפריקה, שם נרשמה עלייה של% 35 במספר הנדבקים החדשים בין השנים 2001 - 2011, ועלייה של 17% במוות הקשור לנגיף. שיעור ההדבקה ממשיך לעלות גם במזרח אירופה ובמרכז אסיה, שם גם חלה עלייה של 21% במוות הקשור לאיידס.
עוד על ההתמודדות עם איידס
- פרסום ראשון: עלייה של 12% בנשאי HIV בישראל
כל ההדבקות החדשות אירעו בתחילת המאה ה-21 בעולם שבו הידע על יעילות השימוש בקונדומים למניעת איידס קיים מזה שנים. למרות זאת, השימוש בקונדומים איננו נפוץ במידה מספקת בקרב הקהל הרחב, כולל בארצות שבהן שיעור ההידבקויות באיידס גבוה במיוחד.
התרופה שעוזרת להתגבר
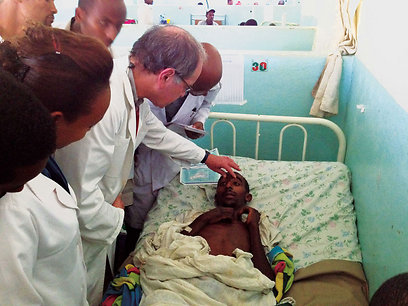
הירידה בתמותה מאיידס קשורה קשר הדוק לשימוש בתרופות אנטי-רטרו-ויראליות (ART-Anti Retroviral Therapy), ונגישות לטיפול הזה לנשאים ברחבי העולם. נגיף ה-HIV מתביית וחודר לתאי מערכת החיסון התאית של הגוף והורס אותם או פוגע בתפקודם, דבר אשר מוביל לכך שנשאי הנגיף מוגדרים כ"מדוכאי חיסון", שמתקשים להתמודד עם מחלות זיהומיות מסוימות שאנשים בריאים מתגברים עליהן בקלות.
דוגמאות למחלות זיהומיות "אופורטוניסטיות" כאלו הן השחפת, הלישמניה, הטוקסופלזמוזיס, הפנאומוציסטיס, ה-CMV וההרפס. התרופות האנטי-רטרו-וויראליות, שנכנסו לשימוש נרחב ב-1996, מונעות מהנגיף להתרבות בתאי מערכת החיסון, מפחיתות באופן ניכר את הרס מערכת החיסון ומפחיתות ביותר הדבקת תאים חדשים בגוף.
אבל התרופות האלו אינן מעלימות באופן מוחלט את הנגיף מגוף הנשא. הירידה בכמות הנגיף המשתכפל בגוף מאפשרת שיחזור פונקציונאלי וכמותי של תפקוד מערכת החיסון התאית, ירידה בשיעור הזיהומים האופורטוניסטים והארכה משמעותית בתוחלת החיים. בשל יכולת גבוהה ליצור מוטציות עמידות לתרופות אנטי-ויראליות, צריכים נשאי הנגיף לקחת מישלבים של לפחות שלוש תרופות על בסיס קבוע וללא הפסקה.
אסטרטגיות חדשות למניעת הדבקה
נשאים אשר מקבלים טיפולים אפקטיביים כרוניים נמצאו כבעלי סיכוי נמוך יותר להדביק אחרים בהשוואה לנשאים שאינם מקבלים טיפול בתרופות. עובדה זו מעוררת תקווה שניתן יהיה למנוע את התפשטות הנגיף על ידי מתן טיפול תרופתי לנשאי הנגיף מוקדם ככל האפשר- כמעט ברגע גילוי נשאותם.
אסטרטגיה נוספת למניעת הדבקה היא מילת מבוגרים. בסדרת מחקרים שנעשו לפני פחות מעשור נמצא שנשים אשר קיימו יחסים לא מוגנים עם גברים שנימולו בילדותם נדבקו בשיעור מופחת בכ-60% מנשים שקיימו יחסים לא מוגנים עם גברים לא נימולים.
בשנים האחרונות פותחה אסטרטגיה נוספת: מתן תרופות כטיפול מניעתי לאנשים בריאים שחשופים למגעים מיניים עם נשאי נגיף או עם אלה הנמצאים בסיכון להיות נשאים.
ריפוי איידס באמצעות תרופות?
עדות ראשונה ליכולת אפשרית של ריפוי על ידי מתן מוקדם של תרופות אנטי-וירליות פורסמה על ידי רשות הבריאות הפדרלית האמריקנית - NIH, במרס 2013. במקרה זה, ילד בן שנתיים אשר נולד כנשא וקיבל טיפול מידי ומלא בקוקטייל עד גיל 18 חודשים נמצא ללא עדות לנגיף בגיל שנתיים.
הילד נמצא במעקב מאז סתיו 2012, ונכון להיום לא ניתן למצוא עדות לקיום הנגיף בגופו. הוא מוגדר "בריא מבחינה פונקציונלית" (functionally cured). עם זאת, עדיין לא ברור כיצד הילד נרפא והאם יישאר לא נשא לאורך זמן.
למרות הממצאים המבטיחים האלה סביב הטיפולים האנטי-וירליים כטיפול ומניעה, יש לזכור כי עדיין אין הוכחות לכך שהתרופות יכולות לסלק לגמרי את הנגיף מגופם של נשאים. לכן, ב-2013 לא נראה עדיין שחלוקת תרופות אוניברסלית לכל הנשאים ברגע התגלות המחלה תתפתח לכדי אסטרטגיה כלל עולמית למניעה של הפצת הנגיף. שיקולי עלויות וסכנה מוחשית להתפשטות בעולם של זני נגיף עמידים עומדים מאחורי ההכרה הזאת.
עם זאת, נראה שמתן מוקדם יותר ויותר של טיפול אנטי-ויראלי אכן יתפתח לאסטרטגיה טיפולית כלל עולמית שמטרתה להאט את הפצת הנגיף באוכלוסייה. ראוי לציון בהקשר זה שנכון לשנת 2011 רק 54 אחוז (שמונה מיליון) מכלל הנשאים במדינות מתפתחות אשר זקוקים לטיפול תרופתי מקבלים אותו - ועם זאת, נתון זה מהווה הישג משמעותי ביחס לשנים עברו.
תגובת מערכת החיסון וסוגי חיסונים
אחת המטרות החשובות ביותר כיום היא פיתוח חיסון לנגיף, אשר ימנע באופן גורף את התפשטותו. כדי לנסות ולהבין האם אנחנו קרובים היום לפיתוח חיסון כזה ומדוע הוא עדיין לא קיים, נסקור את מבנה הנגיף, תגובת מערכת החיסון אליו וכיווני מחקר שונים למציאת חיסון יעיל.
כדי להבין את המערכת החיסונית ואת תגובתה לזיהומים נגיפיים ניתן להשוות אותה למערכת ההגנתית של מדינה. לצורך השוואה הגדרנו את נושאי התפקידים במערכת החיסונית ואת המקבילים להם במערכת ההגנתית:
1. נגיף (uirus) - גרעין הנושא מידע גנטי, המסוגל לנוע בחופשיות במחזור הדם במשך תקופה קצרה, אך אינו מסוגל להשתכפל, אלא אם יחדור לתוך תא חי כלשהו וישעבד אותו למטרותיו. כלומר, הוא חייב פונדקאי כדי להתרבות. לצורך השוואה - הנגיף הוא האויב.
2. תאים בולעניים - מקרופגים (macrophage) - כדוריות לבנות המשוטטות כל הזמן במערכת הדם וברקמות. תפקידן לזהות, לבלוע ולעכל תאים וגופים מיקרוסקופיים זרים שחדרו לגוף, כגון נגיפים, חיידקים, חלקיקי עשן וניקוטין. בזמן העיכול של הנגיף על ידי הכימיקלים המופרשים בתוך המקרופג, מופיעים נתוני הזיהוי שלו על קליפתו של המקרופג. באנלוגיה שלנו, המקרופגים הם חיילי הבט"ש (ביטחון שוטף) המחזיקים את קווי הגבול ומסיירים לאורכם במשך כל השנה.
3. תאיT מסייעים ((helper T cells - התאים המסייעים או האחראים - גם הם כדוריות דם לבנות, או בשמן האחר - לימפוציטים, ותפקידן לקבל מהמקרופגים את זיהוי הנגיף ולשלוח תאים לוחמים כדי לחסלו. במקביל מעבירים התאים המסייעים מידע ללימפוציטים מסוג אחר.
,
בהשוואה לצבא, תאי ה-B המסייעים הם מפקדות האוגדות, היושבות בשטח, מקבלות נתונים מהיחידות הלוחמות, שולחות כוחות לוחמים מתאימים כדי לעצור את כוחות האויב, ובמקביל מעבירות מידע לרפא"ל על מהות הכוחות, וממליצות אילו אמצעי לחימה צריך לפתח כדי לחסלם.
4. התאים הלוחמים (killer T cells) - לימפוציטים המתמחים בחיסול התאים שהנגיף השתלט עליהם ובחיסול תאים סרטניים. הם מופעלים על ידי התאים המסייעים או האחראים. באנלוגיה, אלו יחידות העילית הלוחמות - יחידות הקומנדו, המופעלות על ידי מפקדי האוגדות.
5. תאי B ( cells)- לימפוציטים היושבים בעיקר בבלוטות הלימפה ואחראים על ייצור חומרים ביולוגיים, נוגדנים, שהותאמו במיוחד לחיסול הנגיף הספציפי בעת שהותו הקצרה במחזור הדם. באנלוגיה, זוהי הרשות לפיתוח אמצעי לחימה (רפא"ל). היא מקבלת את הנתונים על האויב הפולש וסוגי הנשק שלו, ואחראית לפיתוח אמצעי נגד מתאימים ולשליחתם לגזרות הלחימה.
6. הנוגדנים(antibody) - מטען ביולוגי שיוצר במיוחד במטרה לחסל את הסוג הספציפי של הנגיף, אשר תכונותיו נלמדו על ידי תאי ה-B. הנוגדנים זורמים עם הדם, מגיעים לאזור החדירה ועוזרים בחיסול הנגיפים שטרם חדרו לתאים או כאלה שיצאו מתאים מודבקים בדרכם לתאים אחרים.
כלומר, הנוגדנים, מאחר שאינם תאים, אינם מסוגלים לפגוע בנגיפים שנמצאים בתוך תאים אלא רק בנגיפים חופשיים חוץ-תאיים. באנלוגיה, הנוגדנים הם יחידות חי"ר המסוגלות להילחם באויב רק כאשר הוא עדיין גלוי, לפני שחדר והשתלט על מוצב או על טנק. הנוגדן אינו מסוגל לחדור לתוך התא, משום שרק תא מסוגל לחסל תא שנכבש.
7. לימפוציטים שהם תאי T מפקחים (suppressor T cell) - מנגנון הפיקוח התאי של הגוף היודע לקבוע שהסכנה חלפה, ולהורות למערכת החיסונית לחדול מהתקפתה לפני שתצא מכלל שליטה. באנלוגיה, זהו המטכ"ל, המחליט על הפסקת פעילות הכוחות הלוחמים לאחר ששוכנע שהאויב הושמד.
8. תאי זיכרון (memory cells) - לאחר שהנגיף הוכרע ממשיכה כמות קטנה של לימפוציטים לסייר במערכת הדם כדי לאתר חדירה נוספת של הנגיף הספציפי שאותו למדו לחסל, במטרה לצמצם את זמן התגובה ולחסלו מיד עם החדירה מחדש. באנלוגיה שלנו מדובר בכוחות הבט"ש המצוידים במודיעים ובנשק, במטרה לסכל את חדירתם של כוחות האויב המוכר.
9. מערכת התקשורת בין סוגי הלימפוציטים השונים מורכבת מחומרים מסיסים, חלבוניים, הנקראים אינטרלוקינים או ציטוקינים. הללו מופרשים על ידי תאיT מסייעים ותאים אחרים, ותפקידם לעורר לפעילות ולשמש לתקשורת בין-תאית. החומרים ניתנים למדידה; כמות גדולה יותר שלהם בדם מעידה על פעילות מוגברת של חלק זה או אחר של המערכת החיסונית. המערכת מקבילה למערכת התקשורת בצבא.
תהליך נורמלי של פעילות המערכת החיסונית
לתגובה החיסונית יש ארבעה שלבים: זיהוי האויב, התארגנות להגנה, יציאה להתקפה וחזרה לשגרה. נגיפים חודרים לגוף (יחידות אויב חוצות את הקווים), המקרופגים הנמצאים בדם נתקלים בהם (יחידות הבט"ש נתקלות באויב החודר), המקרופגים בולעים חלק מהם, לומדים את מהותם, ומעבירים את הנתונים ללימפוציטים המסייעים (היחידות נכנסות לקרב ראשוני, לוקחות שבויים, חוקרות ומעבירות את המידע למפקדת האוגדה).
פעילות המתווכת על ידי תאי T השונים היא "התגובה התאית" של מערכת החיסון, ואילו "התגובה ההומוראלית" (של נוזלי הגוף) של מערכת החיסון נובעת מפעילות תאי B המשופעלים אשר מייצרים נוגדנים ספציפיים כנגד הפתוגן.
המטרה של "חיסון אקטיבי" הנו לגרום לגוף להפעיל את כל התגובה של המערכת החיסונית (כולל יצירת תאי זיכרון), וזאת ע"י חשיפתו לגורם שדומה למחולל המחלה, אך אינו מזיק. לעומתו "חיסון פאסיבי" מורכב מנוגדנים כנגד מחולל המחלה ואינו מקנה עמידות ארוכת טווח אלא ניתן לאחר חשיפה למחולל המחלה בכדי למנוע את כניסתו לתאי הגוף.
מבנה הנגיף
בניגוד לדנ"א (DNA), הרנ"א (RNA) מורכב בדרך כלל מגדיל אחד בלבד. HIV-1 מכיל שני גדילי רנ"א - שהוא החומר הגנטי של הנגיף. רנ"א קיים גם בגוף האדם: החומר הגנטי שלנו - הדנ"א, עובר תרגום לרנ"א, ועל בסיס הרנ"א נבנים בתאי גופנו חלבונים אשר אחראים על כל הפעילות המתקיימת בגופנו ולמעשה קובעים גם את תכונותינו.
לנגיף ה- HIV יש חלבון מיוחד (אנזים) הנקרא Reverse Transcriptase (RT), שיכול לתרגם רנ"א לדנ"א (תהליך הפוך מזה שקורה באופן רגיל בתאי גופנו). ה-RT מתרגם את הרנ"א של הנגיף לדנ"א, ובכך מאפשר לו להשתלב בדנ"א האנושי ולהשתלט על התא שאותו הוא מדביק.
התא המודבק, על כל מנגנוניו, "משתעבד" לנגיף ויוצר עבורו חלבונים אשר יוצרים בסופו של דבר עותקים נוספים של הנגיף. הדנ"א הנגיפי, שמשתלב בתוך הדנ"א של התא המודבק, מכיל מידע המקודד ליצירת תשעה חלבונים נגיפיים.
בנגיף ארוזים גדילי הרנ"א וה-RT בתוך קופסית המורכבת מחלבון נגיפי הנקרא p24. מסביב לקופסית הזאת יש מעטפת (env) הבנויה מקרום שומני, ובה שני חלבונים המורכבים גם ממולקולות של סוכר (גליקו-פרוטאינים), והם חשובים מאוד לתפקוד הנגיף.
גליקופרוטאינים אלו נקראים gp120 ו-gp41. שלושה חלבוני gp120 מתחברים לגבעול המורכב משלושה חלבוני gp41. חלבוני gp120 נמצאים חשופים על פני מעטפת הנגיף, ואילו חלבוניgp41 חוצים את קרום הנגיף, וחלקם נמצאים מחוץ לקרום וחלקם בפנים הנגיף. החלק הפנימי של חלבון gp41 מחובר למשתית (סטרומה - תווך תומך) הנמצאת מתחת לקרום השומני של הנגיף, ומורכבת מחלבון נגיפי הנקרא p17.
gp120 מורכב מחמש לולאות שהמבנה שלהן משתנה בין עותקים שונים של הנגיף, הנקראות V1-V5. לולאות אלו חשופות על פני הנגיף ומכילות בתוכן גם אזורים בעלי מבנה זהה בין עותקים שונים של הנגיף, אשר מוחבאים על ידי החלקים המשתנים של הלולאות. מבנה זה נועד להגן על החלקים עם המבנה הזהה ממערכת החיסון, כדי שזו לא תוכל לפתח נגדם תגובה מנטרלת טובה.
תפקידו של gp120 לקשור את החלבון CD4 glycoprotein, שנמצא על תאי מערכת החיסון בגוף האדם, וביניהם תאי T לימפוציטים, תאים דנדריטיים, מיקרוגליה, ומונוציטים. קישור זה מאפשר איחוי בין קרום הנגיף לקרום תא המטרה, המתווך על ידי gp41, ומאפשר את חדירת הנגיף לתא המטרה . gp120 נקשר גם לחלבון נוסף הנמצא על תאי מערכת החיסון- CCR5 או CXCR4 וגם קישור זה עוזר בחדירת הנגיף לתוך תא המטרה שלו.
כיווני מחקר למציאת חיסון
המחקר הקליני (בבני אדם) הראשון שבדק יעילות של חיסון נגד HIV בוצע כבר בשנת 1987, אך נכון להיום, למרות 15 שנות מחקר בתחום, עדיין אין חיסון יעיל לנגיף HIV.
הסיבות העיקריות לכך הן יכולת הנגיף לעבור מוטציות רבות, שמקנות לו כושר התחמקות מעולה ממערכת החיסון התאית, בצד התפתחות הגנתית מתוחכמת במבנהו, שלא מאפשרת יצירת נוגדנים מנטרלים כנגדו, כמקובל ברוב החיסונים הביולוגיים (כגון חיסונים נגד מחלות ילדות מסוג שעלת וחצבת ונגד צהבת B). בחזית החיסון האקטיבי נבחנו במשך השנים אסטרטגיות שונות, וביניהן:
• חיסון מבוסס דנ"א - בשיטה זו מוחדרים גנים של HIV לתוך מולקולת דנ"א בעלת יכולת הכפלה עצמית (פלסמיד), והפלסמיד מוזרק לתוך השריר של המתחסן. גני ה-HIV עוברים תרגום בתאי המתחסן לחלבונים אשר מפורקים לחתיכות חלבון קטנות (פפטידים) המוצגות על פני תאי הגוף. פפטידים אלו גורמים להפעלה של תאי T אשר מפעילים את מערכת החיסון.
• חיסון שבו חיידקיים או וירוסים משמשים כנשאים (וקטור) לגני ה-HIV - בשיטה הזאת גני HIV מוחדרים לתוך וירוסים או חיידקים שהם מידבקים, אך לא יוצרי מחלה. לאחר חדירת הווקטור לגוף חלבוני נגיף ה-HIV מיוצרים ומוצגים על פני תאים מודבקים, או מופרשים לפלזמה ומעוררים את תגובת מערכת החיסון.
• חיסון מבוסס חלבונים/פפטידים ויראליים המיוצרים באופן סינתטי - בשיטה הזאת חלבונים או פפטידים ויראליים שגורמים לתגובה חזקה של תאי B או T המיוצרים באופן סינתטי מוזרקים לגוף הנשא ומעוררים את תגובת מערכת החיסון.
• חיסון מבוסס virus like particles (VLP- בשיטה הזאת מייצרים את מעטפת הווירוס שמכילה את חלבוני המעטפת שלו, אך לא מכילה את ה-RNA הוויראלי. מכיוון שה-VLP דומה לנגיף הוא יכול לעורר את תגובת מערכת החיסון.
חלק מהאסטרטגיות הללו כבר הבשילו לכלל ניסויים קליניים, שכאמור לא הוכיחו את עצמם עד עתה.
ה-bNab ותפקידם בפיתוח חיסון לאיידס
החיסונים הניסיוניים האקטיביים שהוצגו עד כה, נועדו לעורר את מלוא הקשת של תגובות מערכת החיסון. אך המחקר היחיד שהראה אפקט מגן כלשהו (בתאילנד, כאמור) מצא כי ייתכן שאפקט זה קשור לתהליכים תלויי נוגדנים. על כן נתמקד עתה בניסיונות למציאה והבנה של מנגנון הפעולה של ה-bNab.
חשיבות ה-bNab נובעת מכך שלאחר חדירה של HIV לתאי המטרה יש ככל הנראה חלון הזדמנויות בין חמישה לעשרה ימים שבו ניתן עדיין להיפטר מהתאים הנגועים בנגיף.
לאחר פרק זמן זה הנגיף מתפשט לתאי מטרה ברחבי הגוף ומבצע אינטגרציה לתוך ה-דנ"א בתאים אלו, דבר שמוביל ליצירת מאגרים "רדומים" של הנגיף שאינם ניתנים יותר להכחדה. מכאן ש- sterilizing immunity ("חסינות מוחלטת") יכולה להיווצר רק על ידי מניעה של כניסת הנגיף לתאים על ידי bNab, ועליהם להיות מצויים בריכוז גבוה בריריות הגוף שדרכן מתבצעת לרוב ההדבקה (כגון ריריות איברי מין), עוד לפני החשיפה לנגיף.
ואכן, מחקרים רבים הראו כיbNab כנגד אפיטופים הנמצאים על חלבוני המעטפת יכולים למנוע הדבקה ב-SHIV בקופים. SHIV (immunodeficiency virus (simian-human, הוא וירוס איידס של בני אדם שעבר רה-קומבינציה עם וירוס איידס של קוף (simian-human) ומשמש להדבקת קופי מחקר. עם זאת, יצירת נוגדנים כאלו באדם ובכמות גבוהה באמצעות חיסון כנגד נגיף ה-HIV, עדיין מהווה אתגר גדול למפתחיו.
מציאת ה- bNab החדשים מאפשרת גם לנסות ולהבין מדוע הגוף לא מפיק אותם אחרי כל חשיפה ל- HIV ברמה מספקת למניעת הדבקה. בחינת המבנה של bNab שונים אשר מיוצרים במחלה כרונית הראתה כי הם בעלי מאפיינים ייחודיים המרמזים על כך שהם מהווים תוצר של תא B שעבר תהליך הבשלה מסובך, שאינו מועדף על הגוף.
מתוך התובנות החדשות האלו צומחות גם אפשרויות חדשות לפיתוח חיסון ל- HIV. אפשרות חדשה, המוצעת במאמר של Haynes וחבריו שפורסם ב- 2012, היא חשיפה של תאי B למגוון אנטיגנים שונים שנועדו "לדחוף" את תאי ה-B להבשיל בצורה שתאפשר להם ליצור נוגדנים בעלי תגובה מנטרלת יעילה כנגד חלבוני Env.
- קרני להד היא סטודנטית לרפואה שנה ד' באוניברסיטה העברית
- פרופ' מעין הוא מנהל היחידה לרפואת איידס, המחלקה למיקרוביולוגיה קלינית ומחלות זיהומיות, מרכז רפואי הדסה
הכתבה פורסמה בגיליון מאי 2013 של הירחון "טבע הדברים"