פריצת דרך בטכניון בחקר מערכת האוביקוויטין
המחקר נערך על ידי פרופ' אריאל סטנהיל מהטכניון ועמיתיו באוניברסיטת סטנפורד. חתן פרס נובל, פרופ' אהרן צ'חנובר מהטכניון: "העבודה הזו מפענחת לראשונה - דרך ניתוח מבנה מרחבי - את סוד הפרוק של חלבונים שאליהם קשור אוביקוויטין"
מחקר שנערך בטכניון ובאוניברסיטת סטנפורד, ומתפרסם כעת בכתב העת Structure, חושף לראשונה את המבנה של שרשראות אוביקוויטין בעלות שלוש חזרות. את קבוצת המחקר בטכניון הוביל פרופ' אריאל סטנהיל, חבר סגל בפקולטה לרפואה ע"ש רפפורט.
בטכניון הסבירו כי תפקודם של חלבונים בתא החי תלוי בקיפולם התקין. קיפול משובש (proteotoxicity) עשוי להזיק לתא, ובעקבות זאת לגרום נזקים ברמת המאקרו, כלומר ברקמות הגוף ובגוף השלם. נזקים כאלה מעורבים בספקטרום רחב של מחלות ובהן מחלות נוירו-דגנרטיביות כגון אלצהיימר.
מערך ההגנה העיקרי המונע את אותם נזקים הוא מנגנון האוביקוויטין (ubiquitin), שגילויו הוביל לזכייתם של הפרופסורים אברהם הרשקו ואהרן צ'חנובר מהטכניון ושל עמיתם פרופ' ארווין רוז מאוניברסיטת קליפורניה בפרס נובל בכימיה בשנת 2004. מערכת האוביקוויטין מסמנת את החלבונים הפגומים ב"תג מוות" העשוי משרשראות אוביקוויטין, ותיוג זה מוביל לשיגורם לפּרוֹטֵאָזוֹם, שהוא "סל האשפה התאי". לימים התברר כי מערכת זו מעורבת בתהליכים ביולוגיים נוספים.
התגלית של הרשקו, צ'חנובר ורוז פתחה תחום מחקר חדש במדע וברפואה: תהליכים מבוקרים של פירוק חלבונים בתא. כעת, עם פרסום המחקר של פרופ' סטנהיל, נרשם צעד דרמטי בתחום זה: פענוח המבנה התלת-ממדי של שרשראות אוביקוויטין מורכבות (tri-ubiquitin chains).
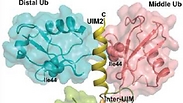
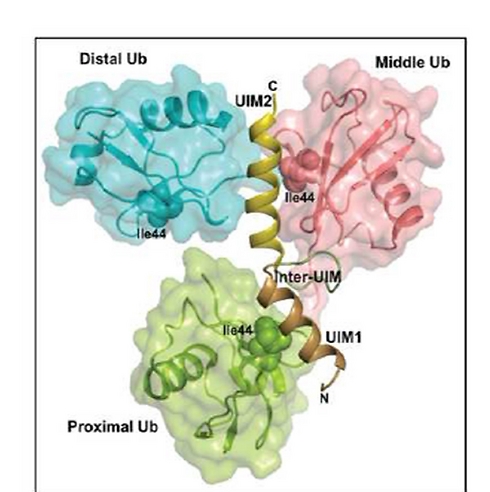
במאמר שפורסם ב-Structure מדווחים פרופ' סטנהיל ועמיתיו על פתרון המבנה המרחבי של חלבון AIRAPL ושל שרשרת תלת-חלבונית של חלבוני אוביקוויטין. הקבוצה גילתה לראשונה כיצד מובחנת שרשרת זו משרשרות אוביקוויטין אחרות, וחשפה את הקישורים במערכת זו. לדברי פרופ' סטנהיל, "זהו תיאור ראשון של קשירת שרשרת אוביקוויטין מורכבת. הצלחנו להראות כי חלבון בשם AIRAPL קושר שתי מולקולות אוביקוויטין באמצעות משטח אינטראקציה ייחודי (UIM2), ובה בעת מאפשר קישור נוסף על קולטן-אוביקוויטין. כך מתאפשרת 'קשירה משולשת' המובילה לשיגור החלבון הפגום לפירוק בפרוטאזום. להערכתנו, המבנה הפתור יאפשר ניבוי של פוטנציאל ההיקשרות של שרשרות אוביקוויטין דומות".
חתן פרס נובל פרופ' צ'חנובר בירך המחקר החשוב ואמר: "עבודה זו של ד"ר סטנהיל ושותפיו חשובה ביותר כי היא
מפענחת לראשונה - דרך ניתוח מבנה מרחבי - את סוד הפירוק של חלבונים להם קשור אוביקוויטין בתצורה אחת מני תצורות רבות שאוביקוויטין נקשר לחלבונים. קישורים שונים מביאים למסלולים תפקודיים שונים בהם מולקולה קטנה זו (האוביקוויטין) 'יודעת' להוליך את החלבונים להם היא נקשרת, אך רק קישור אחד - שאת מנגנונו פענח עתה ד"ר סטנהיל - מביא לפרוק החלבון על ידי ה'מטחנה' התאית הקרויה פרוטאזום. עבודה זו פותחת פתח לפענוח של תצורות קשירה רבות אחרות ולהבנת מכלול פעולותיה של מולקולת האוביקוויטין - גם במסלולים שהפרעה בהם גורמת למחלות, ומכאן אולי גם לפיתוח מושכל של תרופות למחלות אלו, ביניהן ממאירות ומחלות ניווניות של המוח".
למאמר המלא - לחצו כאן