עכברי המעבדה יוכלו לצאת בעתיד הקרוב לחופש, אולי גם לפנסיה מוקדמת. ולא, הסיבה היא לא כי יופסקו הניסויים בהם ועליהם לצורכי מחקר ורפואה, אלא משום שיימצא להם תחליף אנושי. ולא, לא מדובר חלילה על ניסויים בבני אדם. נשמע מבלבל? - אז זהו, שלא.
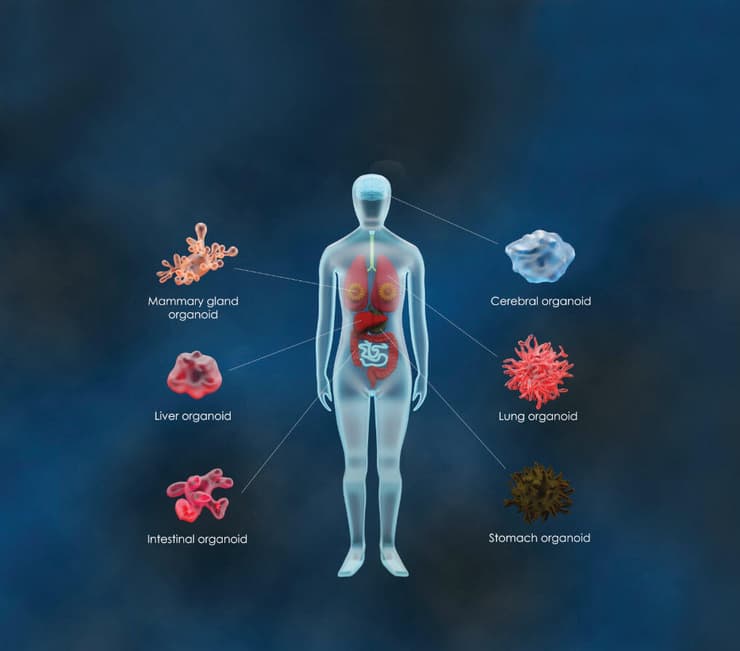
במרכז הרפואי הדסה הקימו לאחרונה את בנק האיברים הזעירים הראשון במדינה. מדובר בטכנולוגיה פורצת דרך, מהמתקדמות ביותר בעולם המחקר ופיתוח הרפואה, אשר מבוססת על אורגנואידים - "מיני איברים", אשר מגודלים בתנאי מעבדה ומשמשים לצורכי מחקר.
היכולת לגדל בתנאי מעבדה "מיני איברים" המכונים אורגנואידים, הפכה למציאות לפני מספר שנים, וכיום הטכנולוגיה הזו משמשת רופאים ואנשי מדע ומחקר ברחבי העולם. זאת לצורכי מחקר רפואי בסיסי ותרגומי, ככלי להבנת תהליכים התפתחותיים פיזיולוגיים ופתולוגיים ולגילוי ופיתוח של אפיקי טיפול חדשניים.
ועכשיו זה קורה גם אצלנו. על הקמת בנק האורגנואידים היחידי בישראל דווח לאחרונה בסימפוזיון רחב, אשר השתתפו בו צוותי מחקר ורפואה דגולים מכל הארץ ומרחבי העולם, והתקיים במרכז הרפואי הדסה עין כרם בירושלים.
מי שהקימו שם את המרכז החדשני הן שתי רופאות בכירות מהמרכז הרפואי בהדסה: ד"ר מרים גרינוולד, חוקרת בתחום הביו־רפואי, וד"ר לירון בירימברג־שוורץ, רופאה בתחום הגסטרו־אנטרולוגיה ילדים, שגם הובילו את הסימפוזיון במטרה להציג את הפלטפורמה החדשה ואת היישומים האפשריים של השיטה.
מהו בעצם אורגנואיד?
"אורגנואיד הוא מבנה רב־תאי, תלת־ממדי, אשר מחקה את הרקמה שממנה הוא נגזר מגוף האדם, הן במבנה שלה והן בתפקוד שלה", מסבירות מייסדות המרכז. "מדובר למעשה בגרסה ממוזערת של איבר חי בשלושה ממדים ועם מיקרו־אנטומיה דומה לזו של האיבר המקורי".
איך בעצם הוא נוצר?
"ניתן לגדל וליצור אורגנואידים מתאי גזע עובריים, מתאי גזע בוגרים הנמצאים ברקמה, או מתאי גזע פלוריפוטנטיים (iPSCs): כלומר תאי גזע שיכולים להתפתח לכל תא בגוף. כשיש לאורגנואידים תנאי גידול נכונים במעבדה, תאי הגזע עוקבים אחר התוכנית הגנטית אשר מוטמעת בהם על מנת להתרבות, להתמיין ולהתארגן במרחב. באופן הזה נוצרים מבנים זעירים, אשר דומים לרקמה שממנה הם הופקו, הן במבנה שלה והן בתפקוד שלה. וזה דבר פורץ דרך".
מאלו רקמות בגוף אפשר ליצור אורגנואידים?
"בפוטנציאל", הן מדגישות, "ניתן לייצר סוגים רבים של אורגנואידים מרוב רקמות הגוף. החוקרים שמשתמשים בטכנולוגיה הזאת, עושים כעת מאמצים לשפר אותה ובכך להרחיב את השימושים הפוטנציאליים בה. זאת באמצעות שילוב של תרביות אורגנואידיות עם סוגי תאים ורכיבי רקמה נוספים, במטרה לחקות טוב יותר את המורכבות של איבר שלם. כזה שיפעל במלואו".
ד"ר גרינוולד, הסבירי בבקשה לאיזה שימוש נועד האורגנואיד? מה המטרה שאתם מייעדים לו בפועל?
"הדמיון המבני והתפקודי של האורגנואידים לרקמה שממנה הם הופקו, ביחד עם יציבותם הגנטית והאפי־גנטית לאורך תקופת תרבית ממושכת, הופכים אותם לכלי מחקרי אידיאלי להערכת יעילותן של תרופות, ומקדמים אותנו צעד נוסף קדימה, לרפואה מותאמת אישית. כמו כן, עם הזמן, המטרה היא שהאורגנואידים יצמצמו את הצורך במחקרי תרופות פרה־קליניים, אשר מבוססים עד היום על שימוש בבעלי חיים.
"השאיפה של כולנו בסוף, היא שיום אחד הטכנולוגיה הזו תוכל להוביל את תחום הרפואה הרגנרטיבית (הנדסת רקמות) ולספק רקמות, אשר ניתנות להשתלה אוטולוגית לשחזור איברים פגומים!".
הבשורה לסרטן הלבלב
בהדסה מקווים כי בנק האוגרנואידים שהקימו ישמש בנק למחקר, כזה שיספק רקמות לחוקרים ויעניק להם שירות. בנק האיברים הזעיר הוקם ביוזמת האגף למחקר ופיתוח של הדסה וקרן מחקרים, בראשותו של פרופ' איל משעני, ובאמצעות תרומות של ארגון נשות הדסה. המשימה המרכזית שהציב בפניו המרכז לאורגנואידים בהדסה, היא לאפשר לקהילה המדעית גישה לאורגנואידים אנושיים, על ידי פיתוח הביו־בנק הישראלי הראשון.
למה הכוונה?
"הבנק הזה מכיל אורגנואידים מוכנים לשימוש, שמקורם ברקמות – הן בריאות והן חולות - אשר נלקחו ממגוון רחב של מטופלים. לטובת המרכז ישנה גם אפשרות לגייס חולים, ולאסוף מהם דגימות בהתאם לשאלת מחקר ספציפית. הדגימות נלקחות ממטופלים כמובן בהתאם לרגולציה ובכפוף לכל האישורים האתיים הנדרשים. כמו כן הבנק מציע ליווי בהקניית המיומנות איך להנפיק ולגדל אורגנואידים עבור חוקרים, אשר יהיו מעוניינים ליישם את השיטה הזאת במעבדות שלהם.
"ולא מדובר רק בדיבורים או בחזון עתידי. במסגרת יום העיון, שהשתתפו בו חוקרים ומדענים מרחבי הארץ ומן העולם, הם שמעו מממציא הטכנולוגיה הזאת, פרופ' הנס קלברס, ממכון הוברכט (Hubrecht) בהולנד, סקירה רחבה על אורגנואידים ויישומים מחקריים, אשר הניבו בפועל תוצאות פורצות דרך. והוא לא היה היחידי שהציג שם הוכחות. המשתתפים נחשפו גם למדענים שונים מהארץ ומחו"ל, אשר פירטו על המחקר המתקדם שהם מסוגלים לבצע, תוך השימוש באורגנואידים".
אחד מהם הוא פרופ' ג'פרי ביקמן מהולנד, אשר תיאר שיטה שפיתח במעבדה שלו ובה משתמשים באורגנואידים של המעי ודרכי הנשימה, על מנת לבחון את פעילות החלבון האחראי להתפתחות מחלת סיסטיק פיברוזיס (Cystic Fibrosis). מדובר במחלה תורשתית, מסכנת חיים, הפוגעת במערכות גוף רבות וגורמת נזק חמור לתפקוד הריאות והלבלב. השיטה שלו נועדה לתיקון הפעילות על ידי מתן תרופות שונות, ולדברי פרופ' ביקמן, היא כבר נמצאת בשימוש רחב על ידי הקהילה המדעית. ביקמן הסביר לנוכחים בכנס, כי הוא פועל לקידום שימוש קליני בשיטה זו על מנת להתאים את הטיפול האופטימלי עבור כל חולי הסיסטיק פיברוזיס, באופן מותאם אישי.
ד"ר ג'וליה ביפי מאנגליה סיפרה בכנס כיצד היא משלבת אורגנואידים שמקורם בסרטן הלבלב, יחד עם פיברובלסטים (תאי סיב) מסוגים שונים, אשר הופקו מהדגימות של סרטן הלבלב, כדי לפענח את יחסי הגומלין בין תאי סרטן לסביבתם. כל המשתתפים הסכימו, כי המחקר זה יכול להוביל לפיתוח שיטות טיפוליות חדשות בסרטן הלבלב.
הבשורה לאוטיזם?
גם לרופאים הישראלים היה במה להתגאות באותו הכנס. ד"ר אלכס גיללס הלל ממחלקת ריאות ילדים במרכז הרפואי הדסה תיאר בפני המשתתפים את עבודתו המשותפת עם פרופ' הנס קלברס, ממציא הטכנולוגיה - עבודה אשר העמיקה את הבנת המנגנון של מחלה גנטית נדירה של דרכי הנשימה.
עמיתו, פרופ' ינון בן נריה מהפקולטה לרפואה באוניברסיטה העברית ירושלים - הציג את מחקרו פורץ הדרך, שאף התפרסם בעיתונות המדעית המובילה בתחום, ותיאר איך האורגנואידים סייעו בהבנת השפעת מטבוליטים שמקורם במיקרוביום, על התפתחות סרטן מעי.
משתתף אחר, ד"ר משה ביטון מהמחלקה לאימנולוגיה וביולוגיה רגנרטיבית (הנדסת רקמות) ממכון ויצמן למדע, תיאר בכנס כיצד מודל של שילוב אורגנואידים של המעי עם תאים ממערכת החיסון חושף פונקציות חדשות של תאי גזע המעי בתגובה אימונית (תגובה חיסונית).
גולת הכותרת בכנס הייתה הבשורה שהביא ד"ר עבד מנסור מהמחלקה לנוירו־ביולוגיה קלינית באוניברסיטה העברית ירושלים. ד"ר מנסור סיפר לנוכחים, כי הוא משתמש במחקרו ב־iPSCs - תאי גזע שיכולים להתפתח לכל תא בגוף - על מנת לייצר אורגנואידים של מוח אנושי. קולטים?
לדברי ד"ר מנסור, הוא כבר השתיל בהצלחה את תאי הגזע המדוברים במוח של עכברי ניסוי, ועקב אחרי התפתחות ותפקוד של תאי מיקרו־גליה (תאים זעירים) אנושיים.
משתפי הכנס הסכימו, כי מעניין במיוחד השימוש במודל ייחודי זה כדי לשפוך אור על תפקודי תאי המוח באנשים עם אוטיזם.
לראות את האור
האם יש עוד מחלות, אשר יתאפשר בעתיד לטפל ולרפא באמצעות בנק האיברים הזעירים? לפי מה שהוצג, נראה כי הכול פתוח והשמיים הם הגבול.
ד"ר גרינוולד מספרת, כי במהלך הכנס הם נחשפו לסיפור האישי והמרגש של חוקרת אמריקאית בשם תמרה פלוצ'ניק, שבנה סובל ממחלה גנטית נדירה הנקראת "רטיניטיס פיגמנטוזה" - מחלת עיניים ניוונית של הרשתית.
במה מדובר?
"זאת מחלה אשר מפחיתה במידה ניכרת את הראייה של בנה, ואין כעת מרפא עבורה".
מדוע?
"אחת מהסיבות לכך שטרם הומצא מרפא, היא העובדה שאין מודל מעבדתי מתאים כדי לחקור את המחלה. גברת פלוצ'ניק תיארה בפנינו את המסע שהוביל אותה להקמת חברה המפתחת אורגנואידים של הרשתית, כדי לקדם את הבנת המחלה ואת האפשרויות הטיפוליות סביבה. דרך זו עשתה בליווי של פרופ' יוסי בוגנים, מומחה ל־iPSCs מהפקולטה לרפואה באוניברסיטה העברית".
פרופ׳ אייל משעני, מנהל האגף למחקר ופיתוח ומנכ"ל קרן מחקרים בהדסה, מסכם: "הקהל הרחב אשר הגיע לכנס, שיקף את הסקרנות וההתעניינות הרבה בטכנולוגיה החדשנית הזו. המדענים מתחומי מחקר מגוונים הדגישו את הפוטנציאל האדיר של שימוש באורגנואידים לקידום מחקר בסיסי ותרגומי, ועוררו השראה בקרב כל הנוכחים. אין ספק, כי הקמת בנק האורגנואידים הוא עוד צעד משמעותי שהדסה עושה, כדי ליישם רפואה מותאמת אישית ולאפשר ביעילות פיתוח תרופתי חדשני וממוקד".