מבט אל פחי האשפה של התא
טכנולוגיה חדשה למיפוי תוצרי הפירוק של חלבונים עשויה להוביל לפיתוח שיטות חדשות לאבחון מחלות אוטואימוניות, סרטן ומחלות מוח ניווניות
כדי להבין לעומק איך פועלים התאים בגופנו - או מה משתבש בפעילותם, כפי שקורה במחלות שונות - נצטרך כנראה להביט גם אל מעבר לגנים שלהם, ומעבר לחלבונים - היישר אל פח האשפה התאי. זו המסקנה העולה ממחקר שביצעה באחרונה קבוצת המחקר של ד"ר יפעת מרבל מהמחלקה לאימונולוגיה במכון ויצמן למדע.
עוד כתבות במסע הקסם המדעי של מכון ויצמן למדע:
אפקט ריק קוונטי הודגם במיכל מים
האם השמועות על מוות תאי היו מוגזמות?
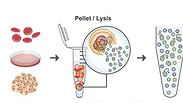
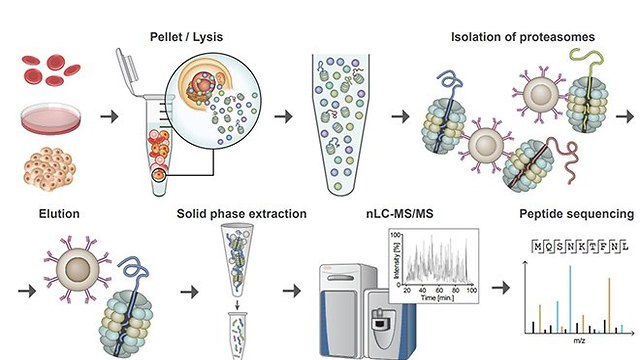
ד"ר מרבל וחברי קבוצתה פיתחו באחרונה טכנולוגיה שמאפשרת מיפוי של תכולת "פח האשפה התאי", שנקרא פרוטאזום, ואשר מציעה מידע על תפקוד התא שאינו זמין בדרך אחרת. הקבוצה יישמה את הגישה החדשה על תאי המערכת החיסונית של חולים במחלה אוטואימונית, תוך חשיפת ראיות ברורות לדפוס ("חתימה") אופייני, המציע כיווני חשיבה חדשים באשר לגורמי המחלה, וכן עשוי להוביל, בעתיד, לפיתוח שיטות אבחון מתקדמות ואף תרופות חדשות. המחקר התפרסם השבוע בכתב-העת המדעי Nature Biotechnology.
כ-70% מהחלבונים בגוף מתפרקים על-ידי יחידות הפירוק והמיחזור של התא, הפרוטאזומים. חלבונים נשלחים לפירוק כאשר הם סיימו את תפקידם או עקב בעיה בתפקוד שלהם ולכן "חלבונים שונים עשויים להיות מיוצרים בכמויות קטנות, יחסית לחלבונים מבניים, ולהיות נתונים לבקרה קפדנית ולפירוק מהיר, כך שבדיקות פרוטאומיקה (בדיקות חלבונים) רגילות, נוטות להחמיץ אותם", אומרת ד"ר מרבל. "אבל אלה הם בדיוק החלבונים החיוניים לתפקוד התא, ולכן תקלות בהם ממלאות תפקיד במחלות רבות".
"שיטות הפרוטאומיקה הנוכחיות", היא מוסיפה, "יוצרות רשימות מפורטות של תכולת החלבונים המבוטאים בתאים. אבל כמו בעבודה בלשית אמיתית, הרבה פעמים אנחנו מקבלים מידע שונה כאשר אנחנו בוחנים את פחי האשפה. מהתבוננות בתצלומים של תכולת בתים נוכל להתרשם מהטעם של אנשים בריהוט ובאמנות, להעריך בני כמה הם ומה תחביביהם. קבלת תמונות רציפות של פחי האשפה שלהם, לעומת זאת, תספר לנו מה הם אוכלים, אלו תרופות הם לוקחים ומה הם קונים – ומתמונות כאלה נוכל לקבל מידע רב יותר באשר לאורח החיים ושינויים דינמיים בחיי היום-יום. באותו אופן, כאשר בוחנים את תכולת פחי האשפה התאיים, מתגלים רמזים באשר לתהליכים שהשתבשו בתאים אלה וגרמו לסימפטומים של המחלה. באמצעות הטכנולוגיה החדשה הצלחנו למפות את מצב המחלה ברמת הפעילות של התא ומחזור החלבונים שלו.
"ככלל, אנחנו מתמקדים בחלבונים שעברו פירוק, מכיוון שגילוי החלבונים שבהם התא השתמש באחרונה עשוי לספר לנו על הפעילויות העיקריות בתא באותה עת", אומרת ד"ר אביטל אייזנברג-לרנר מהמעבדה של ד"ר מרבל. "הוא גם יכול לספק רמזים באשר למצב ניטור החלבון, כמו במקרים של חלבון פגום או חלבון שעבר שינוי שצריך לסלק מהתא. מידע זה הוא בעל ערך גם לצורך זיהוי אירועים אשר עלולים להוביל למחלה. לדוגמה, כאשר גורם גדילה מסוים מסולק מהתא בכמות קטנה מדי, הדבר עלול להוביל להתפתחות סרטן; ומנגד, פירוק יתר של גורם בקרה חיסונית או מעכב דלקת, עלול לתרום להתפתחות מחלות אוטואימוניות".
קבוצת המחקר, שכללה את צוות המעבדה של פרופ' מריאנה קפלן, מומחית לאוטואימוניות מערכתית מהמכון הלאומי לבריאות בארה"ב (NIH), וחוקרים מהמרכז הישראלי הלאומי לרפואה מותאמת אישית על-שם ננסי וסטיבן גרנד במכון ויצמן למדע, התמקדה בזאבת (systemic lupus erythematosus, SLE), מחלה אוטואימונית קשה לאבחון, שאין לה תרופה, ושהגורם לה טרם הובהר. ידוע שזאבת קשורה בתפקוד לא תקין של תאי דם לבנים מסוימים, וכי איברים שונים בגוף מותקפים במהלך המחלה על-ידי המערכת החיסונית.
תפקיד מרכזי בהשגת התובנות והממצאים האלה, מילאה השיטה החדשה שהחוקרים כינו בשם MAPP – Mass spectrometry Analysis of Proteolytic Peptides. "אחד היתרונות העיקריים של מערכת זו הוא בכך שהיא מאפשרת לנו לחלץ מידע על תהליכים לקויים בתאים, אפילו בכמויות קטנות מאוד של חומר ביולוגי, מה שאולי הופך את התהליך לרלוונטי גם מבחינה רפואית", אומרת הילה וולף-לוי, המחברת הראשונה במחקר זה.
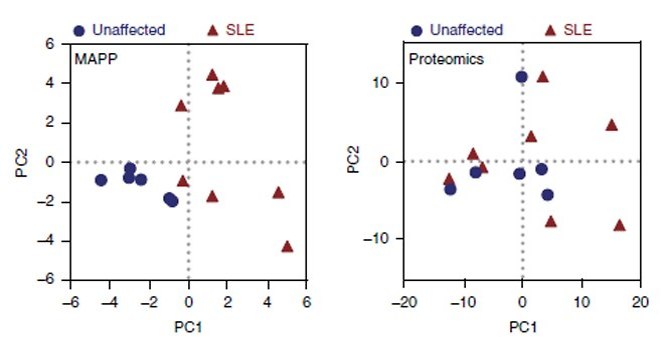
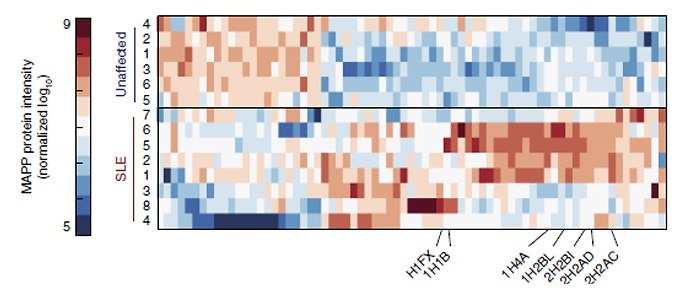
בקבוצת חולי הזאבת אכן נחשף פרופיל MAPP מובהק, המפריד אותם בבירור מקבוצת האנשים הבריאים. יתר על כן, בדיקות החלבונים השגרתיות שמבוצעות כיום ברחבי העולם, ואשר תוצאותיהן הושוו בין שתי הקבוצות, לא הראו את ההבדל בין הקבוצות, מה שמרמז כי חיטוט באשפה התאית עשוי להיות המפתח להשגת תובנות חדשות על מחלה זו ברמה המולקולרית ואולי אף להציע דרכי טיפול נוספות.
מבין החלבונים שנמצאו כמיוצגים ביתר או בחסר בפרוטאזומים של החולים, הבולטים ביותר היו חלבונים מקבוצת ההיסטונים, אשר עברו פירוק ברמה גבוהה יותר. להיסטונים כמה תפקידים חיוניים בתא, אך הם קשורים גם למצבי מחלה, במיוחד מחלות אוטואימוניות, שבהן הם נמצאים בכמויות שמעל לממוצע מחוץ לתאים.
על-פי התפיסה הקיימת, במחלת הזאבת תאי דם לבנים מתים בעודף; הם שופכים את תוכנם, כולל ההיסטונים שלהם, לתוך זרם הדם, והמערכת החיסונית, אשר מזהה את תוספת פפטידי ההיסטון כאנטיגנים זרים, נערכת לתגובה נגד פיסות חלבון מסוימות אלה. "אבל הממצאים שלנו מצביעים על כך שמשהו מתרחש עוד קודם לכן בתאי הדם הלבנים", אומרת ד"ר מרבל. "אלה הם תאים שבדרך כלל לוקחים פפטידים שמקורם בחיידקים או בנגיפים, ומציגים אותם על-גבי הקרום החיצוני שלהם, כמו דגלים קטנים המתריעים בפני המערכת החיסונית על נוכחות פתוגן (גורם מחלה). אנו סבורים שהתאים של חולי הזאבת עושים את אותו הדבר עם הפפטידים הנוספים של ההיסטון, אשר ייתכן שעברו פירוק עקב ליקוי בחלבונים, וכתוצאה מכך, הם עלולים להיות מזוהים כאנטיגנים על-ידי מרכיבים שונים של המערכת החיסונית".
ד"ר מרבל גם מציינת שהניסויים נערכו בביופסיות נוזלים מדגימות דם סטנדרטיות שנלקחו מחולים במרפאה, כך שאם אפשר להראות בניסויי המשך שהחתימה שהתגלתה במחקר ייחודית לזאבת, בין המחלות האוטואימוניות הדומות לה, הבדיקה תוכל לעשות את דרכה - בעתיד - אל מעבדות בית-החולים. המדענים סבורים שרמת הפירוט שהושגה באמצעות השיטה החדשה, עשויה לספק את הרזולוציה הנדרשת כדי לסייע בהבנת המנגנונים הפועלים בבסיסן של מחלות רבות שבהן מעורבים חלבונים פגומים ומערכת הפרוטאזום התאית. אך מה שבאמת מלהיב את ד"ר מרבל ואת חברי קבוצתה, הן האפשרויות העתידיות שפותחת שיטת MAPP: מכיוון שלכל תא יש מכסת פרוטאזומים משלו לפירוק חלבונים משומשים ופגומים, שיטת "איסוף האשפה" התאית עשויה להאיר באור חדש היבטים רבים של ביולוגיה בסיסית ויישומית, ממחלות סרטן ואימונותרפיה לסרטן, עד למחקר בסיסי על ויסות חלבונים.