מחלות לב כרוניות פוגעות בכ-10% מהמבוגרים מעל גיל 65. על אף ההתקדמות הרבה בתחום בריאות הלב, אין כיום דרך לשקם תאי שריר לב שנפגעו כתוצאה מאוטם שריר הלב, רקמת הלב נותרת מצולקת – ומרבית החולים יגיעו בתהליך בלתי הפיך למצב של אי ספיקת לב. באחרונה הראו מדעני מכון ויצמן למדע כי ייתכן שהבלתי הפיך יכול להפוך להפיך: החוקרים ממעבדתו של פרופ' אלדד צחור גילו כי בהינתן האות הנכון, תאי שריר לב בוגרים בעכברים יכולים לחזור אחורה למצב התפתחותי מוקדם יותר ולהחליף את רקמת הצלקת ברקמה חדשה ובריאה.
מרגע הלידה ועד מותנו, תאי שריר הלב כמעט שאינם מתחלקים ומתחדשים. פרופ' צחור מהמחלקה לביולוגיה מולקולרית של התא חוקר כבר שנים את מנגנוני התחדשות הלב האובדים עם לידתנו. בעבר גילו במעבדתו כי יכולת התחדשות הלב נשמרת בעכברים זמן קצר לאחר הלידה, וזאת באמצעות הפעלת הקולטן ERBB2 הנמצא על תאי שריר הלב וידוע כחיוני להתפתחות הלב בעובר. הפעלת הקולטן בתאי שריר לב בוגרים גרמה להעברת אותות שדחפו אותם להתחלק ולשקם ביעילות נזקים שנגרמו כתוצאה מהתקף לב. במחקר החדש יצאה תלמידת המחקר אלה אהרונוב לחקור את המנגנון המולקולרי העומד מאחורי התחדשות הלב באמצעות הקולטן ERBB2 וכן לבדוק אם השפעתו המיטיבה יכולה לבוא לידי ביטוי גם בשלב מתקדם יותר של פגיעה בלב – לאחר שכבר נוצרה רקמת צלקת בלתי הפיכה (לכאורה) ותפקוד הלב נפגם.
2 צפייה בגלריה


אלה אהרונוב ופרופ' אלדד צחור. הפכו את הבלתי הפיך להפיך
(צילום: מסע הקסם המדעי, מכון ויצמן)
לשם כך ביצע צוות המחקר ניסויים בעכברים המצויים כבר באי ספיקת לב והונדסו לביטוי הקולטן ERBB2 בתאי שריר הלב שלהם. הפעלת הקולטנים גרמה לתאי שריר הלב להתחלק ולתאים חדשים להגיע לרקמה המצולקת, מה שהוביל לשיקום תפקודי ואנטומי ניכר של הלבבות. חקירת המנגנון העלתה כי עם הפעלת הקולטנים, חזרו תאי השריר הבוגרים, המאופיינים בחיבור אדוק לשכניהם לצורך פעולת ההתכווצות, לצורה צעירה ו"גמישה" יותר שלהם. למרבה הפלא, תאים "מוצערים" אלו היו גם שונים בצורתם, פיתחו יכולת תנועתית, רופפו קשרים עם שכניהם ואף הפרישו אנזימים מפרקי-צלקות. מאפיינים אלה הם סימני היכר לתהליך המכונה "מעבר אפיתלי-מזנכימלי" (EMT) המאפיין תהליכים בתפתחות העוברית, ולהבדיל, גם התפתחות גרורות סרטניות.
בנוסף הבחינו המדענים גם בשינויים בשלד התא שהובילו לשרשרת תגובות ביוכימיות שבמרכזה המולקולה YAP – הידועה כמקדם חזק של צמיחה וחלוקת תאים. בתאי לב בוגרים ישנם אמנם מנגנוני אכיפה יעילים שמטרתם למנוע הפעלה של מולקולה זו, אך מסלול העברת האותות הראה שהקולטן ERBB2 מפעיל את YAP וגורם לשינויים בשלד התא. הצוות המשיך והנדס עכברים נטולי YAP אשר בהם הופעל הקולטן ERBB2, והראה כי ללא YAP, מרבית ההשפעה של ERBB2 אינה באה לידי ביטוי. דהיינו, מולקולה זו מהווה נדבך מרכזי במסלול העברת האותות שלERBB2 שבסופו של דבר מוביל לחידוש רקמת הלב.
2 צפייה בגלריה
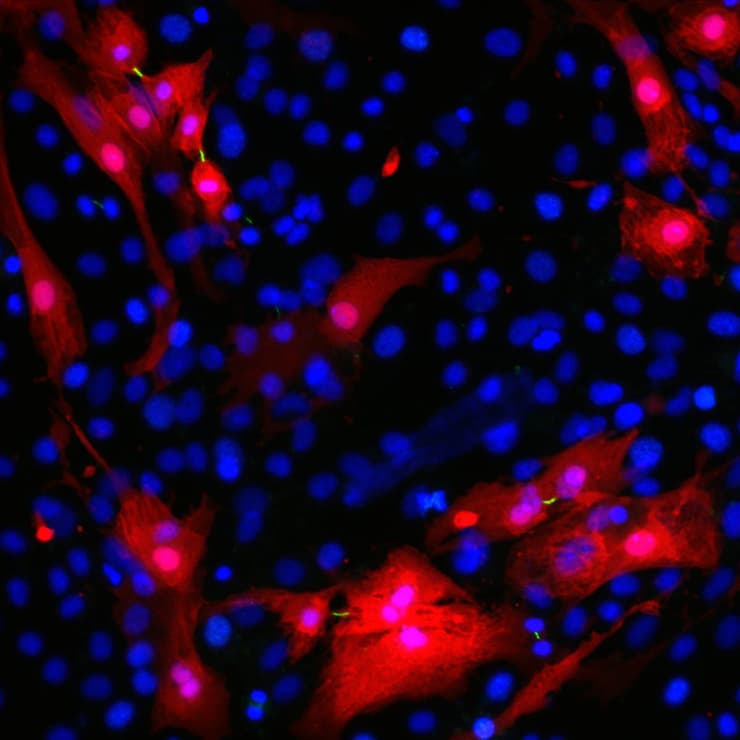

התחדשות רקמת לב תחת המיקרוסקופ. בתמונה ניתן להבחין בפסים דקים ירוקים המסמנים את חריצי ההתלמה (cleavage furrows) הנוצרים בין תאי שריר הלב (באדום) המתחלקים
(צילום: מסע הקסם המדעי, מכון ויצמן)
תהליך התחדשות תאי הלב הבוגרים מזכיר במובנים רבים התנהגות תאים סרטניים בשלב הגרורתי של המחלה. "בעצם, אפשר לומר שיצרנו מעין 'מיני סרטן' בלב, ולכן היכולת להפסיק את האיתות הייתה כה חשובה. כשעצרנו את האותות 'הסרטניים', התאים התמיינו בחזרה לתאים בוגרים שאינם מתחלקים", אומר פרופ' צחור. "בין אם מדובר בהתפתחות עוברית, התחדשות רקמה פצועה, או סרטן – המנגנונים של חלוקת התאים וצמיחתם דומים מאוד", מוסיפה אהרונוב. "מחקר זה מדגים כי מצב של אי ספיקת לב הינו הפיך וניתן לשיקום – מה שנחשב עד כה לבלתי אפשרי. תאי הלב הנותרים, הם עצמם המשאב שיכול לרפא את הלב, בהינתן האות ומשך ההפעלה הנכונים".
במחקר השתתפו גם אברהם שקד, ד"ר כפיר-ברוך אומנסקי, אלכסנדר גנזלינח, ד"ר דוד קין וד"ר דריה לנדנגולץ מהמחלקה לביולוגיה מולקולרית של התא, פרופ' בני גיגר וד"ר אור-ים רווח מהמחלקה לאימונולוגיה, ד"ר אלון סבידור וד"ר ישי לוין מהמרכז הישראלי הלאומי לרפואה מותאמת אישית על-שם ננסי וסטיבן גרנד ושותפים ממוסדות מחקר בארצות-הברית.

