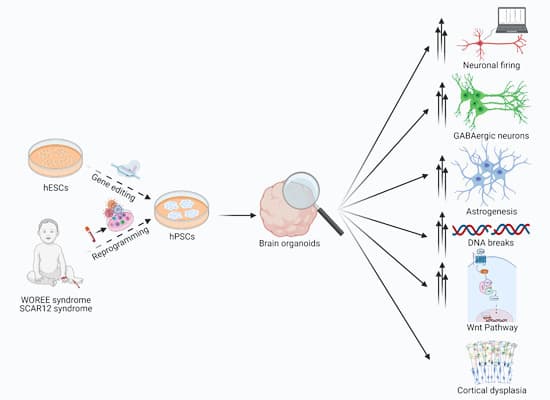
ב-2014 תוארו לראשונה שני סינדרומים נוירולוגים הנובעים ממוטציות בגן WWOX - הראשון, סנדרום "קל" יותר בשם Spinocerebellar ataxia type 12 (SCAR12 syndrome), והשני, סנדרום "חמור" יותר בשם WWOX-related epileptic encephalopathy (WOREE syndrome). שתי המחלות מופיעות בילדות המוקדמת ומאופיינות בין היתר בפגיעה התפתחותית קשה, הפרעות נוירולוגיות פונקציונאליות ובפרכוסים, כאשר WOREE קשור גם במוות בטרם עת. תוחלת החיים הממוצעת של ילדים שחלו בתסמונת WOREE עומדת על 40 חודשים, כך על פי מאמר סקירה שפורסם לאחרונה, ונכון לעכשיו אין תרופה למחלה זו. הילדים יחיו בסבל רב עד למותם. מעט מאוד ידוע על המנגנון ולא קיים טיפול אפקטיבי. על אף שמדובר במחלה נדירה, בישראל תאורו לפחות שמונה מקרים של סינדרומים אלו.
אחד החוקרים המוכרים בעולם לחקר גן ה-WWOX הוא פרופ' ראמי עקילאן, ממרכז לאוטנברג לאימונולוגיה וחקר הסרטן במכון למחקר רפואי ישראל-קנדה (IMRIC) של הפקולטה לרפואה באוניברסיטה העברית, שהחל לחקור את הגן לראשונה בפוסט דוקטורט שלו, ואף המשיך להעמיק את עבודתו המדעית במעבדה שהקים באוניברסיטה.
במהלך תקופת מחקרו קיבל הגן מוניטין רב כחלק מקבוצת גנים המכונים "גנים מדכאי גידול" (Tumor suppressor genes). בעקבות פרסומיו המדעיים ביסס את עצמו פרופ' עקילאן כאחד המומחים הגדולים ביותר בעולם לחקר הגן. לכן, לאחר גילוי הסינדרומים, החלו הורים לילדים חולים מכל רחבי העולם לפנות אליו, חלקם ביקשו שיציל את ילדיהם מהמחלה הקשה. בעקבות כך, למרות שתחום התמחותו הוא סרטן, החליט פרופ' עקילאן להקדיש מאמצים ומשאבים ניכרים לחקר הסינדרומים הנוירולוגים WOREE ו-SCAR12.
במחקר רב-מוסדי חדש, בהובלתו של פרופ' עקילאן, שפורסם בכתב העת EMBO Molecular Medicine, המסתורין מאחורי המחלות מתחיל להיחשף. המחקר מתבסס על פריצות דרך טכנולוגיות של העשור האחרון, שמאפשרות חקר של מחלות אנושיות במודל מותאם אישית למטופל. ראשית, נלקחו דגימות דם מחולים בשני סוגי הסנדרומים, הופקו תאי הדם הלבנים, ודרך טכנולוגית "תכנות מחדש" (Reprogramming) החזירו את התאים למצב דמוי תאי-גזע, אשר מכונה Induced pluripotent stem cells (iPSCs).
לתאים אלו, אומרים פרופ' עקילאן וחוקרים נוספים שהשתתפו במחקר, יש את היכולת להתמיין כמעט לכל תא בגוף, וכך לדמות למעשה את סוגי התאים השונים בגופם של החולים. שנית, תאים אלה גודלו בתלת-ממד כך שיתמיינו לתאים המרכיבים את המוח – בכך נוצר "מיני-איבר" (או "מיני-מוח") בצלחת במעבדה, הממדל את התפתחות מוח העובר האנושי ולכן נקרא "אורגנואיד מוחי" (Organoid = organ like). "השיטה נוסתה לאחרונה נגד מספר מחלות, אפילו לחקר נגיף הקורונה", הסבירו החוקרים.
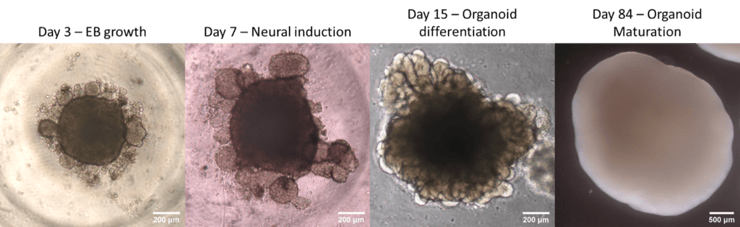
למעשה, ה-iPSCs "נזרעים" בצלחות מיוחדות המונעות מהן להידבק לתחתית הצלחת, ולכן הם נשארים "מרחפים" בנוזל הגידול (מדיום) ויוצרים צבר תאים המכונה Embryoid body, מפני שבדומה להתפתחות העוברית, הוא מאפשר לתאי הגזע להתמיין ספונטנית לכמעט כל סוגי התאים בגוף. לאחר מכן, בהדרגה ולאורך כ-30 יום, מוחלף המדיום בו גדל הצבר למדיום התומך בהתמיינות התאים לתאי המוח.
כלומר, מסבירים החוקרים, רק "מכוונים בעדינות" את התאים לכיוון של תאי המוח, ואז כל תא בוחר בצורה אקראית להתפתח לאיזה תא שהוא בוחר - דבר המאפשר מגוון עשיר של תאים. כשבועיים לאחר תחילת הניסוי, מטביעים את הצברים בחומר מיוחד הנקרא מטריג'ל, שהוא ג'ל עשוי חלבונים אשר מהווה מעין פיגומים המסעיים לצבר לגדול בתלת מימד (3D) וליצור מבנים מורכבים המדמים את התפתחות המוח. אחרי כ-30 יום, ניתן למצוא המון תתי סוגים של תאים המייצגים אוכלוסיות שונות של תאים ואזורים שונים במוח, ולכן הדבר מכונה "אורגנואיד מוחי". את האורגנואיד מגדלים תוך כדי טלטול, וכך למעשה ניתן לאפשר לו להמשיך לגדול, להתפתח ולהבשיל שנה ואף יותר. כך למעשה, מצבר תאים אחיד (תאי גזע, iPSCs) מקבלים "מיני-איבר" הטרגוני (למטה). גישות דומות מייושמות היום על איברים רבים – איברי מערכת העיכול, כליות, עיניים, מערכת המין ועוד.
השלב הבא היה לחקור את המודל החדש שנוצר, ובכך ללמוד מצד אחד את תפקידו של הגן WWOX בהתפתחות המוח, ואת השפעות השינויים (כלומר, המוטציות) בו על התפתחות המחלה. החוקרים השתמשו בשיטות אלקטרופיזיולוגיות, שבהן מודדים את הפעילות החשמלית בנוירונים, ושיטות מולקולריות כמו אימונופלורוסנציה וריצוף RNA, אשר מאפשרות חקר של סוגי התאים השונים במוח, שינויים בחלבונים ובביטוי גנים. כך החוקרים גילו כי בשלבים הראשונים של ההתפתחות מערכת העצבים העוברית, הגן WWOX פעיל באופן ספציפי בתאי האב מהם נוצרים כל תאי המוח, אך לא בתאים הבוגרים. כמו כן, הם גילו כי אובדן הגן גורם לפעילות יתר של נוירונים במוח, לשינויים בהרכב התאים המרכיבים את המוח ולשינויים מולקולריים בתוך התא, דוגמת פגיעה ביכולת התא לתקן נזקים לחומר התורשתי של התאים, ה-DNA. "יש לציין כי שינויים אלה היו ספציפיים למחלה ה'חמורה' (סינדרום WOREE), ממצא המדגיש כי המודל מאפשר להבחין בין מחלות אפילפטיות שונות, ובכך הגישה יכולה לאפשר חקר של סנדרומים נוירולוגים נוספים", הסביר פרופ' עקילאן.
לבסוף, החוקרים בדקו את השפעת החזרת הגן התקין לתאי החולים, וגילו שכך ניתן בעצם "לתקן" את מרבית הפגיעות. על אף ששיטה זאת עוד לא מוכנה לשימוש קליני בחולים, היא פותחת צוהר למחקרים עתידיים בנושא, ותומכת ברעיון כי ניתן לסייע לחולים אלו בגישה של תרפיה גנטית. "יש להדגיש כי זו הפעם הראשונה בה מחלות אלו מודלו באמצעות דגימות אנושיות מחולים, וכי מחקר זה מסייע לסלול את הדרך למחקרים עתידיים להבנת הבסיס המולקולרי של מחלות, ולפיתוח אסטרטגיות טיפול חדשות", הסבירו החוקרים.