תרמודינמיקה היא ענף בפיזיקה שעוסק בקשר בין חום, אנרגיה והפקת עבודה ממערכות פיזיקליות. לתרמודינמיקה יש ארבעה חוקי יסוד, ובדומה לחוקים פיזיקליים אחרים הם משמשים בסיס לתיאוריה רחבה שנוגעת בכל תחומי מדעי הטבע. דריסת הרגל שלה מורגשת במיוחד בתחומי הכימיה והביולוגיה.
התרמודינמיקה פותחה ברובה במהלך המאה ה-19, בשיא המהפכה התעשייתית. במקור היא נועדה לאפשר למדענים ולמהנדסים להבין לעומק איך לנצל בצורה מיטבית את האנרגיה שמופקת במכונות, כמו מנוע קיטור. לפיכך היא התמקדה בשאלות כמו מה קורה לגז שמתפשט או נדחס, ובתהליכים שמתרחשים במנועי קיטור ובמנועי בעירה פנימית - סוג מנוע נפוץ מאוד שקיים למשל במכוניות המונעות בבנזין.
מאנרגיה ועד טמפרטורה
התרמודינמיקה משלבת בתוכה מושגי יסוד חשובים בפיזיקה. הראשון מביניהם הוא אנרגיה. כשפיזיקאים מדברים על אנרגיה הם מתייחסים למידה שמאפיינת גוף, או מערכת של גופים, ומתארת את המצב הפיזיקלי של הגוף בזמן נתון.
עוד כתבות באתר מכון דוידסון לחינוך מדעי:
כמו גפרור שרוף: על שחיקה נפשית של עובדים
הנשק ההגנתי ההתקפי של החיידקים
מחלות ללא גבולות: דנגי חורגת מהמקובל
לדוגמה, לכדור שנמצא במנוחה בראש הר יש אנרגיה פוטנציאלית כובדית, כלומר שנובעת מכבידה, ואפשר לחשב את הגודל שלה. אם הכדור יתגלגל למטה במדרון ההר הוא יאבד מהאנרגיה הכובדית, והיא תתחלף באנרגיה שקשורה בתנועה – אנרגיה קינטית.
אם הכדור יתנגש בכדור אחר, הוא יכול להעביר אליו חלק מהאנרגיה הקינטית שלו ולגרום גם לו לנוע. יש עוד סוגים רבים של אנרגיה, כמו זאת שאגורה בקפיץ דחוס (אנרגיה אלסטית), או זאת שאגורה בסוללה טעונה (אנרגיה כימית).
עבודה היא תהליך שבו גוף או מערכת פיזיקלית מפעילים כוח על גוף אחר, וכתוצאה מכך מעבירים אליו אנרגיה. כשהכדור שגלגלנו מההר פגע בכדור נוסף והעביר אליו חלק מהאנרגיה שלו, אנו אומרים שהוא ביצע עליו עבודה.
גוף יכול לאבד מהאנרגיה שלו באמצעות עבודה שהוא מבצע על גוף אחר, או באמצעות מנגנון נוסף שנקרא חום. כשאנחנו מדברים על חום בשפת היומיום אנחנו מתכוונים בעצם לטמפרטורה גבוהה – כפי שקורה כשאב מנשק את מצחה של בתו החולה ואומר, "יש לך חום". אולם בהקשר הפיזיקלי המשמעות שונה: חום הוא האנרגיה שמועברת בין גופים עקב הבדלי טמפרטורות. כך קורה שכשאנחנו מניחים מחבת קרה על כיריים חשמליות חמות, המחבת תתחמם עקב העברת חום מהכיריים אליה.
גודל אחר שקשור קשר הדוק לתרמודינמיקה הוא האנטרופיה של מערכת פיזיקלית – למשל גוף מוצק או גז שסגור בתוך קופסה. אנטרופיה מבטאת את אנרגיית החום (אנרגיה תרמית) שאגורה במערכת אך אינה זמינה לביצוע עבודה. באופן קצת שונה אפשר להגדיר אנטרופיה כמידת האי-סדר במערכת; לדוגמה, בגביש קרח, המולקולות מסודרות באופן מחזורי ומאורגן. אם הגביש יותך, הנוזל יכיל את אותן מולקולות באי-סדר, כשהן נעות ומתערבבות. האנטרופיה של הנוזל גבוהה מזאת של המוצק.
ולבסוף ישנה הטמפרטורה. לכאורה מדובר במושג ברור ואינטואיטיבי – אם בחוץ שורר שרב והטמפרטורה בצל מגיעה ל-30 מעלות צלזיוס, נרגיש שהרבה יותר חם לנו מאשר בבוקר חורפי צונן של 5 מעלות. אך אינטואיציה אינה פיזיקה. מה זאת אומרת מבחינה פיזיקלית שלאוויר, או לגוף שלנו, יש טמפרטורה של 37 מעלות צלזיוס?
מושג הטמפרטורה קשור למעבר אנרגיה בין גופים, או בין מערכות. אנרגיית חום אגורה בגוף, בדרך כלל, בדמות מידת התנועה של החלקיקים המרכיבים אותו. לדוגמה, המהירות הממוצעת של המולקולות באוויר בטמפרטורה של 30 מעלות צלזיוס גבוהה יותר ממהירות המולקולות באפס מעלות צלזיוס.
5 צפייה בגלריה


אנו יכולים לבשל בזכות מעבר החום מהכיריים אל המחבת, כלומר מעבר אנרגיה עקב הבדלי הטמפרטורה בין הגופים
(צילום: shutterstock)
גם בחומרים מוצקים החלקיקים נעים, אולם תנועתם מתמצה ברטיטות זעירות בלבד. ככל שתהיה למוצק אנרגיית חום גבוהה יותר, הרטט בתוכו יגבר. מעוף החלקיקים באוויר שונה מאוד מרטט החלקיקים בקיר, אך זה לא מונע מאנרגיה לעבור ביניהם. במצב שבו אין מעבר נטו של אנרגיה בין האוויר והקיר, נאמר שלשניהם יש אותה טמפרטורה. מצב כזה, שאין בו מעבר של חום בין גופים, מכונה "שיווי משקל תרמי". טמפרטורה, אם כן, היא המדד שמאפשר לקבוע מתי שני גופים נמצאים בשיווי משקל תרמי.
חוק האפס של התרמודינמיקה: טמפרטורה
ארבעת חוקי התרמודינמיקה ממוספרים בצורה קצת משונה: במקום למנות אותם מאחת עד ארבע, המספור מתחיל באפס. הסיבה לזה היא היסטורית: שלושת החוקים המקוריים פותחו בין אמצע המאה ה-19 לראשית המאה ה-20. רק בשנות השלושים של המאה ה-20 נוסף להם חוק בסיסי יותר. בשל חשיבותו הוא הוצב לפני שלוש החוקים שקדמו לו וקיבל את השם "חוק האפס".
חוק האפס קובע שאם שני גופים נמצאים בשיווי משקל תרמי עם גוף שלישי, אז הם גם בשיווי משקל זה עם זה. בשפה מתמטית אפשר להכליל את הקביעה הזאת על כל מספר של גופים, ומכאן לקבוע כי קיים מדד מוחלט המתאר שיווי משקל תרמי בין גופים – טמפרטורה.
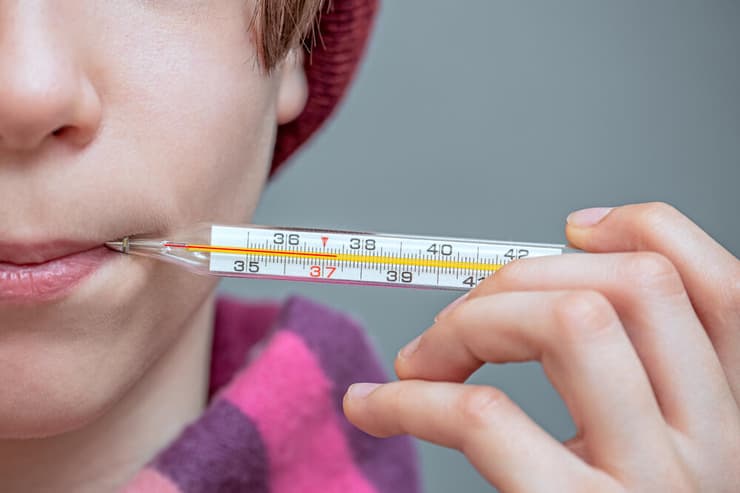
זה העיקרון שעל פיו פועלת מדידת טמפרטורה של גופים. רוב המדחומים מבוססים על רכיב בעל תכונה קלה למדידה שמשתנה בהתאם לאנרגיית החום שלו. כדי להשתמש בו מצמידים אותה לגוף שאת הטמפרטורה שלו רוצים למדוד, עד שהם מגיעים לשיווי משקל תרמי. לדוגמה, בקצה של מדחום חשמלי למדידת חום הגוף יש חוט מתכת שהתנגדותו משתנה בהתאם לטמפרטורה. כשמכניסים את המדחום לפה, הוא מתחמם במהירות מהמגע עם חלל הפה והתנגדותו משתנה בהדרגה ולבסוף מתייצבת כשהמדחום הגיע לשיווי משקל. טבלת כיול ששמורה במכשיר מאפשרת לקשר את ההתנגדות של המדחום לטמפרטורה שלו, ועל סמך החוק האפס של התרמודינמיקה אפשר להסיק שזוהי גם הטמפרטורה של חלל הפה.
החוק הראשון של התרמודינמיקה: חוק שימור האנרגיה
החוק הראשון של התרמודינמיקה קובע שכל שינוי באנרגיה הפנימית של גוף יהיה שווה לסך החום שנכנס לגוף מהסביבה שלו, בניכוי עבודה שהגוף ביצע על הסביבה שלו. החוק הראשון הוא תוצאה של חוק שימור האנרגיה, המוכר מהמכניקה הקלאסית, שקובע שאנרגיה לא הולכת לאיבוד, אלא רק עוברת מגוף לגוף או משתנה מסוג אחד של אנרגיה לסוג אחר.
5 צפייה בגלריה


המנוע לא רק מסובב את גלגלי המכונית, אלא מייצר גם הרבה חום. בוכנות של מנוע בעירה פנימית במכונית
(צילום: shutterstock)
הדוגמה הטיפוסית לחוק הזה היא מה שקורה לגז - למשל אוויר עם רסיסים של תערובת דלק, הלכוד בתוך בוכנה – למשל מנוע של מכונית, ומתפשט לאחר הצתה. המצב הסופי של הגז בבוכנה הזאת, כלומר הלחץ והטמפרטורה שלו, ייקבע לפי כמות העבודה שהגז ביצע על הבוכנה כשדחף אותה ואִפשר לה לסובב את גלגלי כלי הרכב, בצירוף כמות החום שעבר מהגז לסביבתו - למשל דופן הבוכנה.
החוק השני של התרמודינמיקה: חום תמיד יעבור מגוף חם לגוף קר
לחוק השני של התרמודינמיקה יש מספר ניסוחים שקולים מתמטית, עם משמעויות מרחיקות לכת. אחד הניסוחים קובע כי לא יהיה מעבר ספונטני של חום מגוף קר לגוף חם. כלומר לא ייתכן מצב שבו כוס קפה פושר שהושארה בחדר ממוזג תתחמם עם הזמן במקום להתקרר. זוהי מסקנה אינטואיטיבית למדי לכל מי שעיניו בראשו, וכוחו של החוק טמון בראש ובראשונה בכך שהוא מנסח את המתמטיקה שעומדת מאחורי הכלל הזה.
אחת התובנות שנגזרות מחוק הזה היא שלא יכולה להתקיים מכונה שממירה אנרגיית חום לעבודה, שכן החישובים מראים שבמקרה כזה חייב להתרחש מעבר ספונטני של חום ממאגר קר למאגר חם. מכונה כזאת היא סוג של מכונת תנועה מתמדת (פרפטום מובילה). בכל מכונה שמפיקה עבודה חייב לעבור חום ממאגר חם לקר, ובאופן מציאותי גם תמיד יהיה אובדן אנרגיה עקב חיכוך.
אפשר כמובן להעביר חום מגוף קר לגוף חם, אך בשביל זה צריך להשקיע עבודה. לדוגמה, כשאנחנו מפעילים מזגן ביום קיץ חם, הוא יעביר אנרגיית חום מהחדר המקורר, שהטמפרטורה בו עומדת, למשל, על כ-27 מעלות צלזיוס, אל האוויר בחוץ שיכול להיות בטמפרטורה של יותר משלושים מעלות. העבודה שאפשרה את ההעברה הזאת הושקעה באמצעות חשמל.
החוק השני גם מגדיר את קיומה של אנטרופיה, ועולה ממנו שהאנטרופיה בכל מערכת סגורה – כולל היקום כולו – לא יכולה לרדת, אלא רק להישאר זהה או לעלות.
החוק השלישי של התרמודינמיקה: אנטרופיה באפס המוחלט
החוק השלישי של התרמודינמיקה עוסק בערכה של האנטרופיה כשהטמפרטורה מגיעה לאפס המוחלט. האפס המוחלט הוא הטמפרטורה הנמוכה ביותר האפשרית, והיא עומדת על מינוס 273.15 מעלות צלזיוס, כלומר 273.15 מעלות מתחת לנקודת הקיפאון של מים בגובה פני הים. קיומו היה ידוע עוד לפני שפותחה תורת התרמודינמיקה. החוק השלישי של התרמודינמיקה מגדיר את התנאים באפס המוחלט באופן מתמטי, וקובע שככל שמתקרבים לאפס המוחלט, ערכה של האנטרופיה מתכנס לערך קבוע. הערך הזה יכול להיות אפס, אך לא בהכרח.
אחת התובנות שעולות מהחוק השלישי של התרמודינמיקה היא שאי אפשר להגיע לאפס המוחלט, כי כל צעד של קירור דורש עוד ועוד אנרגיה. כלומר אפשר לצנן מערכת כלשהי לטמפרטורות מאוד נמוכות, אך לא להביא אותה לאפס המוחלט, שכן זה ידרוש מספר אינסופי של צעדי קירור. הטמפרטורה הנמוכה ביותר שאליה הגיעו במעבדה כיום היא 38 טריליוניות המעלה מעל האפס המוחלט. הטמפרטורה הנמוכה מאוד הזאת נאמדה בצבר של כמאה אלף אטומים, שהוחזקו בהתקן מיוחד שכלל שדות מגנטיים ותנאים של חוסר כבידה. הערכת הטמפרטורה נעשתה על סמך מדידת תנועת האטומים.
ארבעת חוקי התרמודינמיקה, שנולדו במקור בעיקר כדי להניע את גלגלי המהפכה התעשייתית, הניחו את הבסיס לאחת התיאוריות החשובות והמרכזיות במדעי הטבע. מאז ועד היום היא תרמה תרומה עצומה להבנת תהליכים בטבע, החל באירועים קוסמולגיים שחובקים גלקסיות שלמות ולמעלה מזה, וכלה בתהליכים ביומולקולריים שמתרחשים בקנה מידה מיקרוסקופי בתאי יצורים חיים. כך שבמידה רבה אפשר אולי לראות בה תיאוריה של היקום, החיים וכמעט כול השאר.
דן יודילביץ, מכון דוידסון לחינוך מדעי, הזרוע החינוכית של מכון ויצמן למדע