חוקרים בטכניון פענחו את המבנה האטומי של פפטיד אנטי-חיידקי חשוב במערכת החיסון האנושית וגילו שהוא יוצר סיבים בעלי מבנה מיוחד. להערכת החוקרים, הממצאים עשויים להוביל ליצירת חלקיקים מלאכותיים דומים שישמשו לטיפול ממוקד בזיהומים ואפילו בתאי סרטן. התגלית התפרסמה השבוע בכתב העת Nature Communications.
פֶּפְּטִיד הוא שרשרת קצרה של חומצות אמינו. בניגוד לחלבונים, המכילים בדרך כלל מאות רבות של חומצות אמינו, פפטידים מכילים לכל היותר עשרות חומצות כאלה. אחת מקבוצות הפפטידים החשובות היא קבוצת הפפטידים האנטי-מיקרוביאליים (AMPs), שבה עוסק המחקר הנוכחי. קבוצה זו ממלאת תפקיד משמעותי במערכת החיסון המולדת ומסייעת לה להתמודד עם זיהומים חיידקיים שונים.
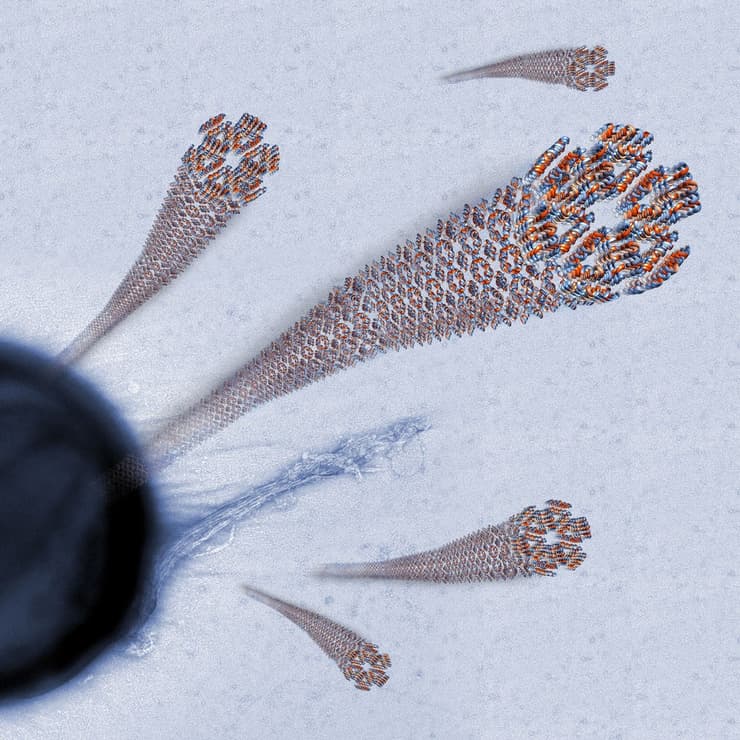
חוקרי הטכניון, פרופ' מיטל לנדאו והדוקטורנט יצחק אנגלברג מהפקולטה לביולוגיה, התמקדו במחקר הנוכחי בנגזרת פעילה של הפפטיד האנטי-מיקרוביאלי (LL-37(17-29 הנמצא בגוף האדם ומסייע לו להיאבק בחיידקים שונים. במחקר, שנערך בטכניון ובמאיצי חלקיקים באירופה, גילו השניים כי אחד האמצעים המשמשים פפטיד זה בקטילת חיידקים הוא סיב חלבוני ייחודי הניחן ביציבות רבה ובעמידות בחום גבוה. החוקרים מיפו את צורת ההתארגנות העצמית (self-assembly) של הסיב - מבנה ארוך, דמוי סרט, המפגין יציבות רבה בתנאים עוינים והיצמדות לתאי חיידקים המאפשרת לו לתקוף את החיידקים מטווח אפס.
בעקבות פענוח המבנה הייחודי של הסיב מציעים אנגלברג ופרופ' לנדאו קונספט חדש לתכנון פפטידיים אנטי-בקטריאליים מלאכותיים עמידים ויציבים, שיחליפו במקרים מסוימים את הטיפול האנטיביוטי. זאת על רקע העובדה שהטיפול האנטיביוטי, שאמנם הציל את חייהם של מאות מיליונים במאה השנים האחרונות, גורם להתפתחות עמידות חיידקית שפוגעת ביעילותו. כידוע, רבים ממקרי המוות בבתי החולים נגרמים כיום מהידבקות בחיידקים עמידים לאנטיביוטיקה – עמידות שהתפתחה בעקבות היחשפות החיידקים למנות גבוהות של אנטיביוטיקה רחבת-טווח.
פפטידים נחשבים כיום להבטחה טיפולית גדולה מפני שלפחות בחלק מהמקרים הם מסוגלים לנטרל את אוכלוסיית החיידקים המזיקים (פתוגנים) מבלי לגרום להיווצרות של עמידות חיידקית לטיפול. קבוצות מחקר רבות בעולם עוסקות בפיתוח פפטידים למטרות רפואיות, והאתגרים ההנדסיים רבים: יעילות, סלקטיביות, התאמה לרקמות הגוף (bioavailability), יציבות באחסון (חיי מדף) ויציבות בגוף לאחר הבליעה.
להערכת פרופ' לנדאו, המחקר הנוכחי הוא צעד חשוב בהגשמתן של מטרות אלה. המבנה האטומי והמולקולרי של הפפטידים הטבעיים, שפוענח במחקר הנוכחי, יאפשר לייצר מבנים דומים שישמשו שלד או אריזה ליישומים שונים בהנדסה ביו-רפואית, ברפואה רגנרטיבית, בביוטכנולוגיה ועוד.
פענוח המבנה המורכב של הסיב החלבוני התבסס על עבודת מחקר במאיצי החלקיקים DESY (גרמניה) ו-ESRF (צרפת) ובמרכזי הטכניון: המרכז לביולוגיה מבנית בטכניון, המרכז הבין-תחומי למדעי החיים וההנדסה ע"ש לורי לוקיי, המרכז למיקרוסקופיית אלקטרונים (מיק"א) ו- Russell Berrie Electron Microscopy Center of Soft Matter. המחקר נתמך על ידי הקרן הלאומית למדע (ISF), משרד המדע והטכנולוגיה והקרן לשיתוף פעולה בין ישראל לארה"ב (BSF).
לאחרונה הכריזה האגודה הישראלית למיקרוסקופיה כי תעניק את פרס מרגוליס לשנת 2020 לדוקטורנט יצחק אנגלברג, וזאת בשל פריצת הדרך המחקרית המתוארת במאמר הנוכחי. ועדת הפרס ציינה כי התגלית היא "הישג מרשים בחקר המבנה של פפטיד אנטימיקרוביאלי אנושי" וכי היא צפויה להוביל ליישומים מגוונים בביוטכנולוגיה, בננוטכנולוגיה, בייצור תרופות אנטי-חיידקיות, בשיקום רקמות ועוד.