התמודדות עם גורמי לחץ (stress) חשובה לא רק לנו אלא גם לתאים שלנו. בתנאי מצוקה קיצוניים יוצרים התאים צברים זמניים הקרויים "גרגירי עקה" (stress granules) העוזרים להם להתמודד עם חום, קור או מצבי מצוקה אחרים העלולים להזיק להם. עם זאת, כאשר גרגירים אלה אינם מפורקים בחלוף הסכנה, הם עלולים להצטבר בתא – כמו מכוניות ישנות הממלאות מגרש גרוטאות. "גרוטאות" אלה, סבורים כיום, עלולות להוביל למחלות ניווניות של מערכת העצבים. מדעני מכון ויצמן למדע, יחד עם שותפיהם למחקר, פיענחו באחרונה את המנגנון המולקולרי שבאמצעותו גרגירי העקה מתפרקים בתאים בריאים והראו כי חיזוק מנגנון זה עשוי לבלום ניוון עצבי האופייני לטרשת אמיוטרופית צידית (ALS).
3 צפייה בגלריה


מימין: חן איתן, נטלי ריבקין, רויטל רביד, חגי מרמור-קולט, פרופ' ערן הורנשטיין, אביעד סיאני, ד"ר צביה אולנדר ויהודה-מתן דנינו. מחזירים לשגרה
(צילום: מסע הקסם המדעי, מכון ויצמן למדע)
גרגירי עקה מורכבים ממולקולות אר-אן-אי ומחלבונים הנקשרים אליהן. ידוע כיום כיצד גרגירים אלה נוצרים, אך עד כה לא היה ידוע כיצד הם מתפרקים. גרגירי עקה פגומים שלא התפרקו כראוי נחשבים לשלב מקדים להיווצרות צברי חלבונים הקרויים גופיפי הֶסְגֵּר (inclusion bodies) ומצויים במוחותיהם של הלוקים ב-ALS, בשיטיון של האונה הקדמית והאונה הרקתית ובמחלות ניווניות נוספות. קבוצתו של פרופ' ערן הורנשטיין מהמחלקה לגנטיקה מולקולרית של המכון חוקרת את תהליך הפירוק של גרגירים אלה במטרה להבין מה קורה כאשר תהליך זה משתבש.
תלמידי המחקר חגי מרמור-קולט ואביעד סיאני ממעבדתו של פרופ' הורנשטייין הובילו את המחקר אשר נערך בשיתוף פעולה עם פרופ' תמי גיגר מאוניברסיטת תל אביב ועם חוקרים מבית הספר לרפואה של אוניברסיטת הרווארד ומהאוניברסיטה של לוון בבלגיה. המדענים פיתחו שיטות מחקר חדשות אשר אפשרו להם לבודד מדורים קטנים ביותר של תאי אדם ולאפיין את כל החלבונים, באמצעות ספקטרוסקופיית מסות. כך מיפו המדענים את תכולתם של גרגירי העקה וזיהו כמאה חלבונים חדשים ותת-מבנים מיקרוסקופיים שלא היו מוכרים עד כה. להפתעתם, הם גילו כי בזמן שהגרגירים עוברים פירוק, הם מגייסים עשרות חלבונים נוספים, המעורבים ישירות בתהליכי הפירוק.
המדענים הצליחו לפענח שרשרת תגובות ביוכימיות חדשה ומפתיעה לפירוק גרגרי העקה המתבססת על תיוג חלבונים להריסה בקוד מיוחד הקרוי "סומו" (SUMO – ראשי תיבות של small ubiquitin-like modifiers) בעבר יוחסו לתגים מסוג סומו תפקידים שונים לגמרי ובמקום שונה לחלוטין: בגרעין התא. לפיכך, החוקרים התרגשו לגלות שפעילות כל כך ספציפית ממלאת תפקיד חיוני ולא צפוי בתהליך פירוק הגרגרים.
3 צפייה בגלריה
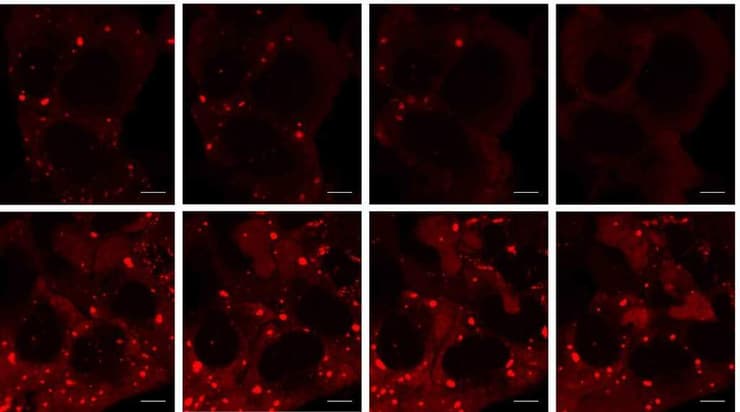

גרגירי עקה (מסומנים באדום בוהק) אשר נוצרו בעקבות מצבי לחץ (משמאל, למעלה ולמטה) התפרקו בתאים רגילים, עם חלוף הלחץ, בתוך שלוש שעות (מימין, למעלה) אך לא התפרקו בתאים שבהם היו חסרים חלבוני "סומו" (מימין, למטה)
(צילום: מסע הקסם המדעי, מכון ויצמן למדע)
המדענים גילו כי ממצאיהם תקפים למחלות מוח ניווניות: לאחר שחשפו תאים לחלבון רעיל הגורם ALS בבני-אדם, גרגירי העקה לא התפרקו כראוי ותגי סומו לא גויסו כהלכה. יתר כל כן, כאשר הפעילו המדענים את מערך הסומו בזבובי פירות שהונדסו כך שיפתחו מחלה דמוית ALS, הם הצליחו לבלום את התנוונות תאי העצב שלהם.
הממצאים פותחים כיוון מחקר חדש של המנגנונים בבסיס ALS ומחלות ניווניות נוספות. "המחקר שלנו עשוי לעודד פיתוח טיפולים עתידיים, שכן הגברת הפעילות של תגי סומו מסתמנת ככיוון חדש ומבטיח לטיפול במחלות עצביות-ניווניות", אומר פרופ' הורנשטיין. מעבדתו של פרופ' הורנשטיין מתמחה כבר שנים רבות בחקר ה-ALS ופיתחה טיפול המצוי בימים אלה בשלב השני של ניסוי קליני בחולי ALS במכון הנוירולוגי של מונטריאול (MNI) בקנדה; טיפול נוסף שפותח במעבדה נמצא בשלב קדם-קליני. שני הטיפולים נסמכים על מנגנונים מבוססי מיקרו אר-אן-אי – מולקולות ביולוגיות זעירות הממלאות תפקידי בקרה שונים בתא.
3 צפייה בגלריה
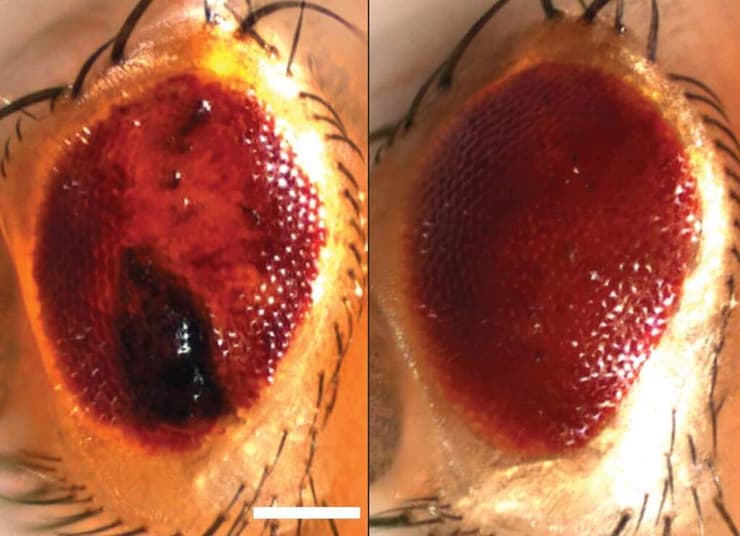

עין של זבוב פירות שהונדס כך שיפתח מחלה דמוית ALS. משמאל: צברי חלבונים פגומים המובילים לניוון דמוי ALS. מימין: העין חזרה למצב תקין בעקבות ביטוי של אחד מחלבוני ה"סומו"
(צילום: מסע הקסם המדעי, מכון ויצמן למדע)
במחקר השתתפו נטלי ריבקין, יהודה-מתן דנינו, ד"ר צביה אולנדר, דאוד שיבאן, ניר כהן, רויטל רביד, חן איתן, ד"ר ביאטה טוט כהן ופרופ' יעקוב חנא מהמחלקה לגנטיקה מולקולרית של המכון; ד"ר טלי דדוש מהמחלקה לתשתיות למחקר כימי של המכון; ד"ר יוסף אדדי מהמחלקה לתשתיות מחקר מדעי החיים של המכון; ד"ר יפעת מרבל מהמחלקה לאימונולוגיה של המכון; ד"ר ננסי קדרשה, שרה הופמן, קלייר ריגס, ד"ר ויוק מ. אדבני, פרופ' פול אנדרסון ופרופ' פבל איוונוב מבית הספר לרפואה של הרווארד; נעמה כנפו מאוניברסיטת תל אביב; ד"ר תומאס ג. מואנס ופרופ' לודו וון דן בוש מהאוניברסיטה של לוון בבלגיה; וד"ר אדריאן היגינבוטום וד"ר ג'ון קופר-נוק מאוניברסיטת שפילד.

