גרגורי ודבורה מקרס מקליפורניה איבדו את בנם גרגורי בשנת 1997 כשהיה רק בן 4. גרגורי לקה בסוג חמור של המחלה הגנטית הנדירה "גוֹשֶה" ונפטר לאחר טיפול ניסיוני שלא צלח. למרות האובדן האישי, הזוג מקרס לא הרים ידיים מריפוי המחלה והקים קרן למימון מחקרים שליוותה כמה מעבדות ברחבי העולם, ובהן מעבדתו של פרופ' אנטוני (טוני) פוטרמן במחלקה למדעים ביומולקולריים במכון ויצמן למדע.
כעת, לאחר כ-25 שנות מחקר, מציגים מדעני המכון במאמר בכתב-העת המדעי Gene Therapy טיפול גנטי חדשני במחלה שהראה תוצאות מבטיחות בעכברים, כולל הארכת חיים דרמטית ושימור יכולות קוגניטיביות.
2 צפייה בגלריה
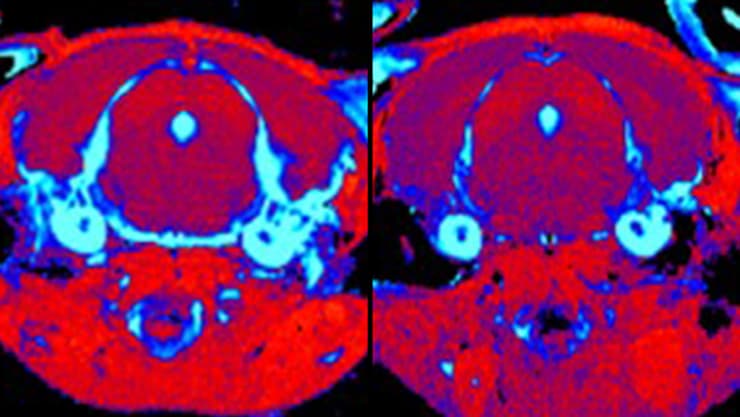

סריקת MRI מוח בעכבר עם מחלת גושה סוג 3 שקיבל טיפול גנטי (מימין) ובעכבר חולה שלא טופל (משמאל). הסריקה חושפת הפחתה משמעותית ברמת הדלקתיות ברקמה שמסומנת בתכלת בעכבר שטופל
(צילום: מכון ויצמן למדע)
גושה נגרמת עקב פגם תורשתי באנזים שתפקידו לפרק חומר שומני בשם גלוקוצרברוזיד; מכיוון שהחומר השומני אינו מפורק, הוא מצטבר בליזוזום – "סל המחזור" של התא שבו מפורקות למרכיביהן מולקולות שסיימו את מחזור חייהן – ומסב נזקים שעלולים להיות קטלניים. המחלה אמנם נדירה מאוד אך מתאפיינת בשכיחות גבוהה יחסית בקרב יהודים ממוצא אשכנזי (מקרה אחד ל-1,200 לידות לעומת 25 מקרים ל-100 אלף לידות באוכלוסייה הכללית).
עם זאת, אשכנזים חולים לרוב בגרסה קלה יותר של גושה – גושה מסוג 1 – שאינה כוללת פגיעה מוחית. שני המופעים האחרים של גושה חמורים בהרבה: הסוג השני כולל נזק מוחי נרחב והידרדרות מהירה המובילה למוות לפני גיל שנתיים, בעוד בגושה מהסוג השלישי, הפגיעה המוחית המובילה למוות מגיעה רק בשלב מאוחר יותר – בילדות או אף בבגרות.
הטיפול המקובל כיום במחלה הוא הזרקות חוזרות של אנזים תקין במטרה להפחית את הצטברות החומר השומני ברקמות הגוף. ואולם טיפול זה אינו מציע ריפוי מלא וגם אינו מסייע בסוגים החמורים יותר של המחלה הפוגעים ברקמת המוח. הסיבה: מחסום הדם-מוח – אותה שכבת תאים צפופה העוטפת את כלי הדם במוח ומונעת ממולקולות גדולות, דוגמת האנזים המוזרק, להגיע ליעד המבוצר. לפיכך, החולים הקשים נותרו עד היום ללא ריפוי. בשנים האחרונות, מתמקדות כמה קבוצות מחקר בעולם במציאת טיפול גנטי למחלה: סוג חדשני של טיפול המאפשר להחדיר באמצעות נגיף עותק תקין של הגן הפגום.
ואולם החדרת עותק תקין של הגן הפגום אינה מספיקה בהכרח כדי לפצות על הפגם הגנטי. לשם כך יצרה מעבדתו של פרופ' פוטרמן שיתוף פעולה עם מעבדתו של פרופ' שראל פליישמן המתמחה בתכנון ושיפור של אנזימים באמצעות מודל ממוחשב. במעבדתו של פרופ' פליישמן נעזרו באלגוריתם מתוחכם שפיתחו כדי לתכנן גן שלא רק יישא את המתכון הנכון לאנזים, אלא יישא מתכון משופר שיוביל לגרסה פעילה במיוחד שלו שתוכל לפצות על הפגם הגנטי ולהילחם בהצטברות החומר השומני.
"החוקרים נעזרו באלגוריתם מתוחכם שפיתחו כדי לתכנן גן שלא רק יישא את המתכון הנכון לאנזים, אלא יישא מתכון משופר שיוביל לגרסה פעילה במיוחד שלו שתוכל לפצות על הפגם הגנטי ולהילחם בהצטברות החומר השומני"
לאחר השלמת הפיתוח של הגן המהונדס, החדירו אותו המדענים בהובלת ד"ר איוון מילנקוביץ' וד"ר שני בלומנרייך מקבוצתו של פרופ' פוטרמן, למוחותיהם של עכברים צעירים עם מחלה המדמה מחלת גושה בגרסתה החמורה וחשוכת המרפא (סוג 3). החוקרים עקבו אחר מצב גורי העכברים לאחר הטיפול לפי השינויים במשקל גופם וביכולות המוטוריות שלהם.
2 צפייה בגלריה


מימין לשמאל: פרופ' שראל פליישמן ופרופ' אנטוני (טוני) פוטרמן שיצרו מתכון משופר לגן הדרוש
(צילום: מכון ויצמן למדע)
הם נדהמו לגלות כי בדומה לעכברים בריאים לגמרי, מרבית העכברים החולים שטופלו בגן המהונדס עלו במשקל ותוחלת חייהם התארכה משמעותית. הם גם שמרו על יכולות התנועה שלהם ועל שיווי המשקל, ואף שיפרו אותן כמעט עד לרמה תקינה לגמרי. מאידך, עכברים שלא טופלו כלל או טופלו בגן בצורתו הטבעית איבדו עד 20% ממשקל גופם בארבעת החודשים הראשונים של הניסוי ויכולות התנועה שלהם הידרדרו עם התקדמות המחלה.
הפחתת תגובת הדלקת במוח
בשלב הבא, התחקו החוקרים אחר המנגנון המסביר את יעילות הטיפול: הם בחנו דגימות מוח מהעכברים וזיהו שהטיפול בגן המהונדס, אך לא בגן הטבעי, הצליח להוריד משמעותית את הצטברות החומר השומני במוח. "אנו משערים שהיציבות המשופרת של האנזים מאפשרת לו לחמוק מפירוק בתא, להחזיק מעמד ולבצע את פעילותו החשובה", אומר פרופ' פוטרמן.
ממצא חשוב במיוחד היה הצלחת הטיפול בהפחתת תגובת דלקת במוח. בשנת 2015 גילתה קבוצתו של פרופ' פוטרמן שחלבון דלקתי מסוים מתבטא ברמות גבוהות במוחם של חולים בגושה מסוגים 2 ו-3, וכי יש מתאם בין רמת ביטוי הגן וחומרת המחלה. כך הם הבינו שלדלקת יש תפקיד מרכזי בפגיעה המוחית וכן שאותו גן הוא סמן להתקדמות המחלה. במחקר החדש, זיהו המדענים כי רמות הביטוי של הסמן הזה ושני גנים דלקתיים נוספים יורדות בחולים שקיבלו את הטיפול החדשני. ממצאים אלו נתמכו על ידי בדיקת MRI שזיהתה ירידה בסימנים לדלקת במוחותיהם של העכברים.
"לאחר חצי יובל שהזוג מקרס מלווה את מחקריי ומתעדכן בכל התפתחות, פיתוח טיפול גנטי חדשני לגרסת המחלה שממנה סבל גרגורי הקטן, היא סגירת מעגל עבורי", אמר פרופ' פוטרמן בהתרגשות: "אנו מקווים למצוא שותפים לקידום טיפול חדשני זה – מניסוי נרחב יותר בחיות ועד לניסויים קליניים בבני-אדם. יש עניין בטיפול גם מעבר למחלת הגושה שהיא נדירה יחסית, שכן מחקרים מראים כי הגן הפגום הוא גורם סיכון למחלת פרקינסון".
במחקר השתתפו גם אריאל הוכפלדר, אביה אזולאי ותמר יוסף מהמחלקה למדעים ביומולקולריים במכון, ד"ר ענבל ביטון, מירי זרביב, ד"ר רוני אורן וד"ר מיכאל צורי מהמחלקה למשאבים וטרינריים.
הכתבה פורסמה באתר מכון ויצמן למדע






