החומר התורשתי הנמצא בתאי גופנו, ה-DNA, מכיל את כלל ההוראות הדרושות לבנייה ולפעולה של גוף האדם. סך כל החומר התורשתי הזה, הנמצא (כמעט) בכל אחד מתאי הגוף שלנו, נקרא "הגנום האנושי" וכולל כ-3 מיליארד זוגות בסיסי DNA. לפני 20 שנה, בשנת 2003, הסתיים פרויקט עצום-ממדים לזמנו – "פרויקט הגנום האנושי", שבו מיפו מדענים מכל העולם את רצף הבסיסים המלא של גנום האדם. במרוצת השנים נוספו לרצף שהתקבל השלמות ותיקונים, הודות לשיפורים הרבים בכלי המחקר, בשיטות ובגישות.
קראו עוד:
אך "רצף הבסיסים המלא של גנום האדם" הוא מונח מטעה, משום שאין רצף אחד ויחיד כזה. גם אם נסתכל על אנשים בריאים בלבד, נמצא הבדלים גדולים בין רצפי ה-DNA שלהם, והדבר אינו מפתיע: הבדלים אלה הם אחד הגורמים העיקריים האחראים להבדלים בין אדם לאדם, שבגללם ובזכותם אנחנו שונים זה מזה. לכן נדרשת עבודת מחקר רבה כדי להבין אילו רצפי DNA השונים מהרגיל קשורים במחלות או בתסמונות גנטיות, ואילו רצפים הם אומנם שונים מהרגיל, אך תקינים ואינם גורמים למחלות תורשתיות או לפגיעה בתפקוד. כיום ידועות יותר מ-10,000 מחלות ותסמונות שמקורן בשינוי בגן יחיד, אך יש גם רצפים רבים השונים מהגרסאות השכיחות של אותו אזור ב-DNA, ועדיין לא ברור אם להבדל הזה יש השפעה ואם כן, מהי.
מה זו מחלה תורשתית?
מחלה תורשתית או תסמונת תורשתית הן מחלה או תסמונת שמקורן ברצפים מסוימים של חומר תורשתי המועברים מהורים לצאצאיהם. רבים סבורים בטעות ש"מחלה תורשתית" ו"מחלה גנטית" הן אותו הדבר עצמו, אבל חשוב להבין שלא כל מחלה גנטית היא מחלה תורשתית. המונח "מחלה גנטית" מציין בדרך כלל מחלות שמקורן בשוני יחיד בגֵן או בכרומוזום. הגֵן או הכרומוזום הפגומים יכולים להתקבל בתורשה מההורים, ואז תהיה זו מחלה תורשתית. אך הפגם יכול להיווצר גם במהלך החיים.
תסמונת דאון, למשל, היא תסמונת גנטית שברוב המכריע של המקרים אינה מתקבלת בתורשה מן ההורים. הגורם לתסמונת דאון הוא מספר עותקים לא-תקין של כרומוזום מספר 21: לעומת שני עותקים של הכרומוזום במצב תקין – אחד שמקורו באם ואחד שמקורו באב – לאנשים עם תסמונת דאון יש שלושה עותקים של כרומוזום זה. השינוי במספר העותקים מתרחש לרוב בזמן יצירת תאי המין (זרע או ביצית) של ההורה, ואילו להורה עצמו אין תסמונת דאון; לכן אין זו מחלה תורשתית.
סוגים רבים של סרטן נגרמים בשל רצף DNA שאינו קיים אצל ההורים אלא נוצר במהלך החיים, וגורם להתחלקות מוגברת של התאים, המובילה לסרטן. שינוי כזה יכול להתרחש בהשפעת קרינה,עישון טבק, נגיפים מסוימים, חשיפה לאסבסט ועוד. לעומתם, דוגמאות למחלות תורשתיות המועברות מהורים לילדיהם הן סיסטיק פיברוזיס, ניוון שרירים על שם דושן וחלק ממקרי סרטן השד.
אם מחלה היא אכן תורשתית, ונובעת משינוי בגן יחיד, היא יכולה להתבטא באחד מכמה אופנים עיקריים. הבה נסקור אותם.
החומר התורשתי של האדם מאורגן ב-23 זוגות כרומוזומים: זוג כרומוזומי מין ו-22 זוגות כרומוזומים שאינם כרומוזומי מין, הנקראים אוטוזומים. בכל כרומוזום יש אזורים המכילים גֵנים, שהם רצפי הוראות לייצור מולקולות פעילות ספציפיות, רובן המכריע – חלבונים. הגֵנים שעל 22 מזוגות הכרומוזומים שלנו קיימים בשני עותקים: עותק שקיבלנו מאימנו ועותק שקיבלנו מאבינו.
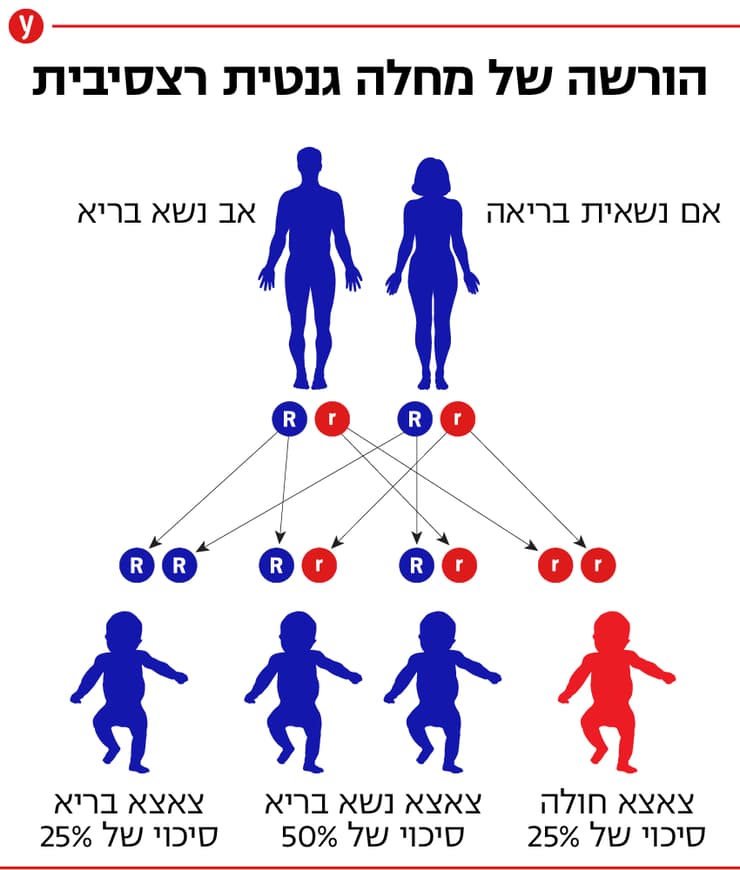
מחלה תורשתית שהגן האחראי לה נמצא על אחד מ-22 האוטוזומים נקראת, בהתאם לכך, מחלה אוטוזומלית. אם הגן למחלה הוא דומיננטי, מספיק שיש עותק אחד שלו בתא כדי לגרום למחלה, גם אם הגן שעל הכרומוזום השני הוא תקין. מחלה כזו נקראת מחלה אוטוזומלית דומיננטית. אם הגן למחלה הוא רצסיבי, הוא גורם מחלה רק אם יש בגוף שני עותקים שלו, גם על הכרומוזום שמקורו באם וגם על הכרומוזום שמקורו באב. מחלה כזו נקראת מחלה אוטוזומלית רצסיבית.
כל המחלות הגנטיות נובעות מפגם בחומר התורשתי, אך לא בכולן הפגם עובר בתורשה; לעיתים הוא נוצר בזמן יצירת תאי המין שמהם התפתח העובר או במהלך החיים
אך מלבד 22 זוגות הכרומוזומים האלה, ישנו גם זוג כרומוזומי המין. בבני אדם, בגופן של נקבות יש שני עותקים של כרומוזום המין הנקרא כרומוזום X, ואילו בגופם של זכרים יש כרומוזום X אחד וכרומוזום נוסף קצר בהרבה, הנקרא כרומוזום Y. גנים פגומים הנמצאים על כרומוזום X גורמים לכמה וכמה מחלות וליקויים תורשתיים, ובהם עיוורון צבעים ומחסור באנזים G6PD. מרבית המחלות האלה הן רצסיביות, כלומר מתבטאות רק בהיעדר גרסה תקינה של הגן. מכיוון שלנקבות יש שני כרומוזומי X, הן יסבלו ממחלות ומצבים אלה רק אם יקבלו את הגן הפגום משני הוריהן. לזכרים יש רק כרומוזום X אחד, ולכן מספיק גן פגום אחד כדי לגרום למחלה. משום כך עיוורון צבעים ומחלות וליקויים אחרים שהגנים האחראים להם נמצאים על כרומוזום X הם שכיחים הרבה יותר בקרב גברים מאשר בקרב נשים. מחלות תורשתיות כאלה נקראות "מחלות הנמצאות בתאחיזה למין".
6 צפייה בגלריה


הגן הפגום לליקוי נמצא על כרומוזום X. ילד עובר בדיקת עיוורון צבעים
(צילום: Shutterstock)
נסכם ונאמר שכל מחלה תורשתית היא מחלה גנטית, אך לא כל מחלה או תסמונת גנטית הן תורשתיות. כל המחלות הגנטיות נובעות מפגם בחומר התורשתי, אך לא בכולן הפגם עובר בתורשה; לעיתים הוא נוצר בזמן יצירת תאי המין שמהם התפתח העובר או במהלך החיים. מחלה תורשתית הנובעת מגן רצסיבי ונמצאת בתאחיזה למין תהיה שכיחה הרבה יותר אצל בנים מאשר אצל בנות. ולבסוף, מחלות רבות, ובהן סוכרת מסוג 2, מחלות אוטואימוניות שונות ומומים מולדים מסוימים, מושפעים הן משינוי בגנים והן מגורמים סביבתיים. למעשה, למרבית המחלות יש מרכיב תורשתי כלשהו.
איך מאבחנים מחלה גנטית?
האבחנה של מחלה גנטית מתבצעת לרוב על ידי רופא או רופאה מומחים בגנטיקה. האבחון דורש בדיקה מקיפה המורכבת משלושה חלקים: בדיקה פיזית, סקירה מפורטת של ההיסטוריה המשפחתית ובדיקה גנטית במעבדה (אם ניתן). יש כמה "דגלים אדומים" העשויים לעורר חשד שמדובר במחלה תורשתית: מחלה המופיעה אצל כמה אנשים במשפחה, בייחוד קרובים מדרגה ראשונה; הפלות חוזרות; לידות שקטות, כלומר לידות של תינוקות שאינם בין החיים; ומקרים של מוות טבעי בילדוּת. תסמינים קליניים נוספים שאופייניים לעיתים למחלות גנטיות כוללים איחור התפתחותי, מוגבלות שכלית התפתחותית ומומים מולדים. כאשר כמה מאפיינים קליניים כאלה מופיעים יחד באותו אדם – למשל, שילוב של מוגבלות שכלית התפתחותית, תווי פנים מיוחדים ומום בלב – הדבר מעורר חשש כבד במיוחד לתסמונת גנטית בשם תסמונת דאון, שהוזכרה קודם.
לעוד כתבות של מכון דוידסון:
בדיקה גנטית
בדיקה גנטית עשויה להידרש בכמה מצבים: כאשר אדם מסוים סובל ממחלה וברצוננו לאבחן אותה ולהבין אם מדובר במחלה תורשתית; כאשר בני זוג העומדים להביא ילד לעולם רוצים לדעת אם הם בסיכון מוגבר ללדת ילדים עם מום או מחלה גנטיים; כאשר לאדם מסוים יש רקע משפחתי של מחלת הסרטן והוא רוצה לדעת אם הוא נמצא בסיכון מוגבר לחלות בסרטן; כאשר מטופל חולה בסרטן, ורופאיו רוצים לבדוק את הבסיס הגנטי למחלה כדי להתאים לה טיפול; ועוד.
6 צפייה בגלריה


בדיקה גנטית עשויה להפחית את הסיכון ללידת ילדים עם מום או מחלה גנטיים. בדיקה גנטית מולקולורית
(צילום: Tek Image / Science Photo Library)
קיימות כמה שיטות לביצוע בדיקה גנטית במעבדה, בהתאם לסוג המחלה: בדיקה ציטוגנטית, כלומר בדיקה של הכרומוזומים; בדיקה ביוכימית, כלומר בדיקת הפעילות של חלבון; ובדיקה מולקולרית, כלומר בדיקה של רצף ה-DNA.
בדיקות סקר גנטיות
בדיקות סקר גנטיות נועדו לאתר הורים-לעתיד הנמצאים בסיכון מוגבר ללדת ילד שעלול להיות חולה במחלה גנטית. הבדיקות מתבצעות לפני ההיריון או בתחילת היריון, והן נועדו לזהות כמה מחלות שבישראל נבחרו על ידי משרד הבריאות. אלו הן מחלות קשות, שאין להן תרופה ואשר שכיחותן באוכלוסייה גבוהה יחסית למחלות גנטיות. מרבית המחלות הנבדקות הן אוטוזומליות רצסיביות, והמטרה היא לבדוק אם שני ההורים הם נשאים של הגן הפגום ("נשאים") ועלולים להוריש אותו לעובר. מכיוון שנשאות היא תכונה סמויה (אדם אינו יודע שהוא נשא עד שיבצע בדיקה), בדיקות הסקר מומלצות לכלל האוכלוסייה, גם ללא היסטוריה משפחתית של מחלות או מומים מולדים.
הבדיקות מותאמות לבני הזוג על פי מוצאם, מכיוון שמחלות שונות נפוצות באוכלוסיות ממוצאים שונים. מלבד סל הבדיקות הממומן על ידי המדינה, אפשר לשלם באופן פרטי על בדיקה של נשאות למחלות רבות נוספות, שמרביתן נדירות יותר או חמורות פחות. זוגות הנמצאים בסיכון ללידת ילד חולה נשלחים לייעוץ גנטי כדי לבדוק אפשרויות שונות שיסייעו להם להביא לעולם ילדים בריאים. בדיקות הסקר הגנטיות מסייעות במניעה של חלק משמעותי מהמחלות התורשתיות.
6 צפייה בגלריה


התרופות שנוטל חולה סיסטיק פיברוזיס מדי יום. אחת מבדיקות הסקר הגנטיות המוצעות בישראל היא לגילוי נשאות ל-CF
(צילום: Shutterstock)
טיפול במחלות תורשתיות
רבות מהמחלות התורשתיות משפיעות על כמה מערכות בגוף, וכיום עדיין איננו יודעים לרפא את מרביתן. אך יש כמה גישות לטיפול בחולים ולהפחתת תסמיני המחלה.
אידאלית, אילו יכולנו להחליף או לתקן את הגן הפגום, היה אפשר לרפא לחלוטין מחלות תורשתיות. תיקון כזה נקרא ריפוי גני (gene therapy). חוקרים הצליחו להביא בדרך זו לריפוי מלא של מחלות תורשתיות בכמה חיות מודל, אך יישום השיטה בבני אדם נתקל בקשיים רבים, למרות אסטרטגיות שונות שנוסו לתיקון הגן הפגום. למשל, כאשר השתמשו בנגיפים כדי להחדיר לגנום את הגן התקין, נתקלו בבעיה חמורה: אין לנו שליטה על המקום שבו יוחדר הגן התקין לגנום. כאשר הגן נכנס למקום אקראי בגנום, הוא עלול לפגוע בפעילותם של גנים אחרים, ולגרום למחלות שיכולות להתבטא גם שנים אחר כך. לכן, למרות המאמצים העצומים שהושקעו בפיתוח, עד היום אישר מינהל המזון והתרופות של ארצות הברית, ה-FDA, רק טיפולים ספורים מסוג זה.
קבוצה מסוימת של מחלות תורשתיות מתאפיינת בהפרעה בחילוף החומרים עקב פגיעה בייצור או בפעילות של אנזים מסוים. לעיתים אפשר לטפל במחלות אלו בעזרת שינוי בתזונה. כאשר מגבילים מרכיבי מזון מסוימים, הדבר יכול למנוע הצטברות של חומרים רעילים, שהאנזים התקין מפרק אותם ואילו האנזים הפגוע של החולה אינו מסוגל לפרקם. לפעמים שינוי כזה בתזונה יכול לשפר תסמינים קיימים, ולפעמים הוא יכול רק למנוע החמרה במצב.
6 צפייה בגלריה

בישראל נבדקים כל היילודים למחלת פנילקטונוריה. בדיקת רמות פנילאלנין בדם היילוד
(צילום: Simon Fraser / Science Photo Library)
דוגמה למחלה מטבולית תורשתית כזו היא פנילקטונוריה (PKU). מחלה זו נגרמת מחוסר בפעילות של אנזים בשם פנילאלנין הידרוקסילאז בכבד. בהיעדר האנזים הפעיל, מצטברות בגוף כמויות גדולות של פנילאלנין, אחת מחומצות האמינו שהן אבני הבניין של חלבונים מכל הסוגים. הצטברות פנילאלנין גורמת למחלה חמורה של מערכת העצבים ולמוגבלות שכלית התפתחותית. לפיכך מקובל כיום להנחות את החולים להקפיד על דיאטה קפדנית נטולת חומצת האמינו הזאת. על החולים להימנע מאכילת מזונות עתירי חלבונים כמו בשר, מוצרי חלב וקטניות ומצריכה של הממתיק המלאכותי אספרטיים. גם מזונות אחרים עליהם לצרוך בכמות מוגבלת בלבד, ולשים לב לכמות הפנילאלנין שבהם. כיום מייצרים מזונות מיוחדים המספקים לחולים את רוב דרישות החלבון, השומן והקלוריות של הגוף ללא פנילאלנין. בישראל, כמו במדינות רבות אחרות, כל היילודים נבדקים למחלה זו, כיוון שאבחון מוקדם מאפשר טיפול והתפתחות תקינה. מכיוון שתזונה מיוחדת זו היא בגדר טיפול יעיל למחלה זו, בישראל אין כיום המלצה לבדוק אותה במסגרת בדיקות הסקר הגנטי לפני ההיריון.
יש מחלות תורשתיות הקשורות לסיכון מוגבר לבעיות בריאות בגיל מאוחר. כזו היא למשל תסמונת מרפן, הפוגעת בחלבון מבני שיוצר סיבים אלסטיים המחזקים את רקמות הגוף
במחלות תורשתיות מטבוליות מסוימות משתמשים בטיפול באנזים חלופי. בטיפול מסוג זה ניתן לחולים אנזים המחליף את האנזים הטבעי הפגום, שהפגיעה בתפקודו היא שגרמה למחלה. על פי רוב, האנזים החלופי מוחדר באינפוזיה ישירות לדם החולה. אחת המחלות שאפשר לטפל בהן כך היא מחלת גושה. המחלה מסווגת לסוגים שונים על פי החומרה וגיל הופעת התסמינים (הסוג הנפוץ בישראל הוא קל יחסית). הגורם למחלה הוא פגם בגן המקודד לאנזים האחראי לפירוק שומנים מסוימים בדם. כאשר אנזים זה פגום ואינו פועל כראוי, שומנים אלה מצטברים וגורמים לפגיעה באיברים שונים ובעצמות. טיפול במחלה באמצעות אנזים חלופי מאפשר פירוק שומנים תקין.
במחלות המתאפיינות ביצירת תאי דם פגומים, כמו אנמיה חרמשית, אפשר לטפל על ידי השתלת מח עצם. ההשתלה עשויה לאפשר יצירה של תאי דם תקינים, ואם היא מתבצעת בשלב מוקדם, היא יכולה למנוע רבים מהסיבוכים.
לפעמים אפשר רק להקל
במחלות תורשתיות אחרות, הטיפול כולל בעיקר ניסיון להקל את התסמינים האופייניים למחלה. דוגמה מסוג זה היא סיסטיק פיברוזיס (לייפת כיסתית), מחלה רב-מערכתית הנגרמת מפגם בחלבון האחראי להעברת מלחים דרך תאי הגוף. חולים במחלה זו סובלים מהפרשות צמיגות הגורמות לחסימות במערכות שונות בגוף כדרכי הנשימה, דרכי המרה, הלבלב ועוד. כדי להקל את התסמינים נותנים לחולים טיפול אנטיביוטי הבולם זיהומים, תרופות המרחיבות את הסמפונות ומצמצמות את הנפיחות סביב דרכי הנשימה, תרופות שגורמות לליחה להיות פחות צמיגה, תחליפי אנזימי לבלב ועוד. גם פיזיותרפיה עשויה לשפר מאוד את איכות החיים של החולים. במקרים קשים, כאשר החולים סובלים מכשל נשימתי והטיפולים התרופתיים נכשלים, ממליצים לעיתים על השתלת ריאות.
יש מחלות תורשתיות הקשורות לסיכון מוגבר לבעיות בריאות בגיל מאוחר. כזו היא למשל תסמונת מרפן, הפוגעת בחלבון מבני שיוצר סיבים אלסטיים המחזקים את רקמות הגוף. סיבים אלו נמצאים בכל מקום בגוף, ופגיעה בהם מתבטאת לרוב במערכות הלב וכלי הדם, השלד והעיניים. הסיבוך הקשה ביותר של המחלה הוא הרחבה של שורש אבי העורקים – כלי הדם המרכזי היוצא מהלב – העלולה להיות קטלנית. הטיפול במחלה כולל שמירה קפדנית על לחץ דם תקין כדי למנוע החמרה של מצב אבי העורקים, מעקב בעזרת הדמיות כדי לאתר במהירות שינויים במצב, אורח חיים מתאים (כגון פעילות גופנית מתונה) וטיפול תרופתי. כאשר בכל זאת מתרחשת הרחבה של שורש אבי העורקים, אפשר לעיתים לתקן זאת בניתוח.
יש מחלות תורשתיות שהשפעתן קשה כל כך, שהן אינן מאפשרות חיים. במקרים חמורים עלולה להתרחש הפלה ספונטנית של העוברים. במקרים אחרים העובר עשוי למות בתוך הרחם או היילוד עשוי למות זמן קצר לאחר הלידה. במקרים אלו מספקים טיפול תומך, הקלה של הכאבים ועזרה מכנית בנשימה במקרה הצורך.
"גרם של מניעה עדיף על קילוגרם של תרופה"
מחלות תורשתיות הן מגוונות מאוד בסוג התורשה האחראי להן, בתסמינים, בשיטות האבחון ובטיפול בהן, אך כולן נובעות מהחומר התורשתי שהחולים קיבלו מהוריהם. למרבית המחלות התורשתיות אין מרפא ידוע, והטיפול מתמקד בהקלת התסמינים ובמניעת סיבוכים. מכיוון שכיום עדיין אין בידנו לרפא את החולים ברוב המחלות האלה או לספק להם טיפול שיעניק להם איכות חיים ראויה, אנו משקיעים משאבים רבים במניעה של הופעתן מלכתחילה, בעזרת בדיקות סקר גנטיות ולעיתים על ידי אבחון טרום-לידתי, במהלך ההיריון.








