נכון להשבוע, יותר משלושה מיליון ישראלים קיבלו את המנה הראשונה של החיסון נגד נגיף הקורונה, SARS-CoV-2. כמעט שני מיליון נוספים קיבלו גם את המנה השנייה, ובעולם כולו חוסנו כבר כמאה מיליון איש. המרוץ לחיסון הביא עימו תקוות גדולות, אך לצדן גם חששות, תהיות ולא מעט דיסאינפורמציה.
לאחרונה מופצות ברשתות החברתיות הודעות שמביעות חשש שמא החיסון גורם ל"הגברה תלוית נוגדנים" (ADE, ראשי תיבות של Antibody-Dependent Enhancement). בקצרה, זהו תהליך שבו אדם שיש בגופו נוגדנים לגורם מחלה מסוים, עלול לסבול מתגובת יתר של מערכת החיסון בפעם הבאה שבה יידבק באותו גורם. במצב כזה, במקום שהנוגדנים שבגופו ישפרו את המצב, הם יובילו דווקא למחלה חמורה יותר.
קראו עוד:
ההפחדות שמופיעות ברשתות החברתיות, דוגמת דיבורים על "התמכרות לחיסונים" או טענות כי "ירידת נוגדנים תוביל תוך שישה חודשים למחלה הסופנית ADE", נשענות על חצאי אמיתות, על ליקוט מידע בררני נטול הקשר ועל חוסר הבנה. תופעת ה-ADE מוכרת, ידועה והייתה על השולחן כבר בשלבי המחקר והפיתוח המוקדמים של החיסון. לא מדובר בנושא חדש או בסוד שמנסים להסתיר: מתנהלים סביבו מחקר ודיון מדעיים רבים כבר מהשלבים הראשונים של התפרצות הקורונה. חשוב גם להבין שמדובר בתכונה של המחלה, לא של החיסון נגדה, ושנכון להיום ממצאי המומחים מעידים שהתופעה הזאת אינה קיימת במחלת COVID-19.
כדי להבין במה מדובר, יש להבין תחילה מעט יותר כיצד פועלת מערכת החיסון.
4 צפייה בגלריה

מתחסנים בסורוקה. במהלך פיתוח החיסונים נערכו בדיקות, מחקרים וניסויים רבים לבדיקת האפשרות להגברה תלוית נוגדנים, והתנהל דיון אקדמי מקיף
(צילום: דוברות סורוקה)
נגיף, נוגדנים והחיסון שביניהם
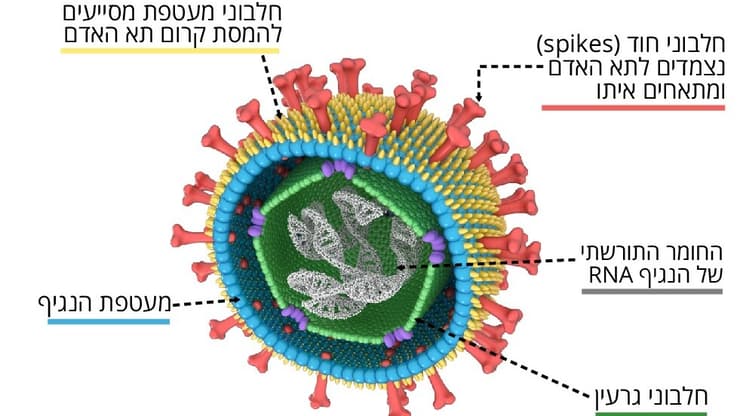
נגיפים אינם מסוגלים להתרבות בעצמם ועושים זאת בתא מאחסן. הם נקשרים לתא וחודרים אליו באמצעות החלבונים שעל המעטפת החיצונית שלהם. לדוגמה, לנגיף הקורונה SARS-CoV-2, מחולל המגפה העולמית שאיתה אנו מתמודדים כעת, יש חלבון המכונה "ספייק" (זיז), שנקשר לחלבון בשם ACE2 הנמצא בצד החיצוני של חלק מהתאים שלנו. ה"מנעול" וה"מפתח" האלה קובעים לאילו תאים יהיה הנגיף מסוגל להיקשר ולחדור. אלו הם התאים שבהם הוא מתרבה ומפיץ עותקים חדשים של עצמו לרחבי הגוף.
כשמערכת החיסון הנרכשת שלנו פוגשת מחולל מחלה בלתי מוכר, היא לומדת אותו ומייצרת נוגדנים ותאי חיסון ייעודיים נגדו. התהליך הזה עשוי להימשך בין שבועיים לשלושה שבועות, בפרק זמן ממושך שבמהלכו מחולל המחלה עלול לגרום נזק רציני. לכן, נוסף על ייצור הנוגדנים עצמם, המערכת מייצרת ומאחסנת גם תאי זיכרון. כך, אם אותו מחולל מחלה יפלוש לגוף פעם נוספת, תאי הזיכרון יאפשרו תגובה מהירה: ברגע שהפולש יזוהה, יוזעקו תאי הזיכרון המתאימים לו וייצרו במהירות שוב את הנוגדנים המותאמים אליו. כך הוא ינוטרל ויפורק לפני שיספיק לגרום נזק. זהו זיכרון חיסוני.
ההפחדות שמופיעות ברשתות החברתיות, דוגמת דיבורים על "התמכרות לחיסונים" או טענות כי "ירידת נוגדנים תוביל תוך שישה חודשים למחלה הסופנית ADE", נשענות על חצאי אמיתות, על ליקוט מידע בררני נטול הקשר ועל חוסר הבנה
חיסוני הקורונה הנוכחיים, ובכלל זה החיסונים של החברות פייזר ומודרנה, מעוררים את מערכת החיסון להגיב כלפי אותו חלבון ספייק, כך שהיא מייצרת נוגדנים ותאי חיסון נגדו בלי שנדבקנו בנגיף עצמו. אם ניחשף לנגיף בפועל, כבר יהיו בגופנו התאים והנוגדנים הדרושים כדי להילחם בו בצורה מדויקת ויעילה מיד עם חדירתו לגוף, והמחלה תימנע.
בתהליך זה של יצירת הזיכרון החיסוני מיוצרים בין השאר נוגדנים המכונים "מנטרלים". תפקידם למנוע מחלבון הספייק להיקשר ל-ACE2 וכך לסכל את חדירת הנגיף לתא. פרט לנטרול, נוגדנים שנקשרו לנגיף מזעיקים תאים מחסלים, שבולעים את הנוגדן עם הנגיף שקשור אליו (פַגוֹצִיטוֹזָה).
"הגברה תלוית נוגדנים", ADE, היא תופעה שבה נוכחות של נוגדנים עלולה במקרים מסוימים להעצים את חומרתן של הדבקות בנגיפים. התופעה דווחה לראשונה בתגובה החיסונית של הגוף לנגיף דֶנְגִי כבר לפני כ-20 שנה, ונמצאה גם ב-HIV (מחולל מחלת האיידס), בקדחת צהובה, זיקה, קדחת הנילוס המערבי ובכמה נגיפים של דרכי הנשימה.
ADE עלול להתרחש בשני מנגנוני פעולה. האחד נגרם כשהנוגדנים אינם יעילים מספיק בנטרול גורם המחלה, ובאחר כשנוגדנים נקשרים לנגיף באופן שמעורר תגובת יתר של מערכת החיסון ודלקת. המנגנון שיופעל תלוי בסוג הנגיף שבו מדובר.
4 צפייה בגלריה

בדיקה סרולוגית בשיבא. רשויות הבקרה ממשיכות לעקוב לאורך זמן כדי לוודא שלא יהיו הפתעות בלתי צפויות
(צילום: אביגיל עוזי)
הדבקה מוגברת בזכות שימוש בנוגדנים
תפקידם של נוגדנים שאינם מנטרלים הוא להיקשר למעטפת הנגיף ולאותת לתאי חיסון בולעניים לבוא ולעכל את הפולש. הנוגדן משמש מעין עוגן, או גשר, בין תא החיסון לבין הנגיף. אצל נגיפים שתוקפים תאים של מערכת החיסון עצמה, העוגן מסייע לנגיף להתקרב לתא החיסון וכך להדביקו. במקרה כזה, לא רק שהתא אינו מעכל את הנגיף ומפרק אותו, אלא שהנגיף אף מצליח להתרבות בתוכו. כך התאים הבולעניים נהיים מטרה קלה יותר לנגיף, ובמקום שיהיו חלק מהפתרון הם דווקא מחריפים את חומרת המחלה.
נגיף דֶנְגִי, שתוקף תאים בולעניים של מערכת החיסון, הוא דוגמה קלאסית למנגנון כזה של "סוס טרויאני". אם הנוגדנים אינם מתאימים באופן מדויק לנגיף, הם אינם מצליחים לנטרל אותו ביעילות מלאה, והוא מצליח להתרבות בתוך התאים הבולעניים. ה-ADE נגרם במקרה הזה מכיוון שיש ארבעה זנים של נגיפי דנגי: כשיש בגוף נוגדנים לזן אחד, הם אינם מנטרלים ביעילות מספקת את הנגיפים מהזנים האחרים, אם נידבק במקרה באחד מהם.
בקובה, למשל, הייתה בשנת 1977 התפרצות של נגיף דנגי מזן אחד. כעבור 20 שנה, ב-1997, התפרץ באי זן אחר. מחקרים הראו שבהתפרצות השנייה שיעור התחלואה היה גבוה הרבה יותר אצל מי שחלו בעבר בדנגי מהזן הראשון. לרוע מזלם של הקובנים, בשנת 2001 הגיע למדינה זן שלישי של הנגיף, וכמעט כל אלה מהנדבקים מ-1977 שנדבקו כעת מחדש, חוו הפעם מחלה קשה.
הפעלה מוגברת של מערכת החיסון
כשנוגדנים שאינם יעילים מספיק נקשרים לנגיף, הם עלולים ליצור צְבָרִים שנקראים קומפלקסים חיסוניים. הקומפלקסים יכולים להצטבר ברקמות המודבקות (לדוגמה בתאי ריאה) ולעורר תגובה דלקתית חזקה שמגבירה את עוצמת המחלה. המנגנון הזה קיים למשל אצל נגיפים נשימתיים כמו RSV (או Respiratory Syncytial Virus) הגורם לדלקת שעלולה להוביל לחסימה בדרכי הנשימה ואף למצוקה נשימתית. המנגנון הדלקתי עצמו הוא חלק חיוני ממערכת החיסון, אבל כשהאיזון מופר, הדלקת ממשיכה להתפתח באופן לא מבוקר כמו שקורה ב-ADE, ורואים החמרה בתסמיני המחלה.
מנגנון כזה של ADE נצפה למשל בחצבת, כאשר קופים שחוסנו בנגיף מומת ואז הודבקו בחצבת חוו מחלה חמורה יותר.
מאחר שחיסונים מדמים "מקרה קל" של המחלה, עשוי להתפתח ADE לא רק אחרי הידבקות חוזרת במחלה עצמה אלא גם כשאדם נדבק בנגיף אחרי שחוסן נגדו. על כן תופעת ה-ADE עוררה בעיה בפיתוח חיסונים נגד נגיפי דנגי, אבולה, HIV, RSV ואף כמה נגיפים ממשפחת הקורונה. מכאן נבע בתחילת המגפה הנוכחית החשש שמא התופעה עלולה להתרחש גם כלפי נגיף SARS-CoV-2, ולכן עלולה לשבש את פיתוחו של חיסון יעיל למחלה.
מאחר שחיסונים מדמים "מקרה קל" של המחלה, עשוי להתפתח ADE גם כשאדם נדבק בנגיף אחרי שחוסן נגדו. התופעה עוררה בעיה בפיתוח חיסונים קודמים, ומכאן נבע החשש שהיא עלולה להתרחש גם כלפי נגיף הקורונה
התופעה ונגיפי הקורונה
יש נגיפים ממשפחת הקורונה שהתגלו בהם תופעות דמויות דנגי אצל בעלי חיים. ADE תואר למשל בנגיף ממשפחת הקורונה בשם FIPV, התוקף חתולים (Feline Infectious Peritonitis Virus), שחודר לתאים בולעניים בשם מַקְרוֹפָגִים. במקרה הזה פעל המנגנון הראשון של הדבקה מוגברת בעזרת נוגדנים.
אבל למרות קרבתו המשפחתית ל-FIPV, נגיף הקורונה הנוכחי, SARS-CoV-2, אינו תוקף את אותם תאים בגוף. מחקרים הראו שהוא אומנם מסוגל לחדור לעיתים למקרופגים, אבל אינו מתרבה בתוכם. למעשה, התאים הבולעניים ממלאים תפקיד חיובי במאבק במחלה בנוכחות נוגדנים, משום שהם עוזרים להפחית את העומס הנגיפי. אם כן, נראה שהמנגנון של ADE המושתת על חדירת הנגיף לתאי מערכת החיסון אינו רלוונטי לנגיף הקורונה הנוכחי.
בדומה לבני משפחתו, נגיף הסארס (SARS-CoV-1) והמֶרס (MERS-CoV), נגיף SARS-CoV-2 מתמחה בחדירה לתאי אֶפִּיתֶל, הנמצאים בשכבה הדקה המפרידה בין איברים לסביבתם. הוא תוקף בעיקר את תאי האפיתל ברֵיאות, וכך גורם למחלה נשימתית. לכן החשש במה שנוגע לנגיף הנוכחי היה מהמנגנון השני של ADE – גרימת דלקת שמפעילה את מערכת החיסון בדרכי הנשימה באופן לא מידתי ועלולה להוביל למצוקה נשימתית.
התאים הבולעניים ממלאים תפקיד חיובי במאבק במחלה בנוכחות נוגדנים, משום שהם עוזרים להפחית את העומס הנגיפי. נראה שהמנגנון של ADE המושתת על חדירת הנגיף לתאי מערכת החיסון אינו רלוונטי לנגיף הקורונה
בניסויים שנעשו בפיתוח חיסונים נגד נגיפי מֶרְס ונגיפי סארס, שהתבססו על נגיפים מומתים או מהונדסים, נוצר בחלק מהמקרים ADE במפגש עם הנגיף החי. בניסיונות טרום-קליניים עלה חשש מפני התופעה הזאת, בעיקר בעכברים ובניסויי מבחנה (in vitro), אך במקרים אחרים לא נתקלו בתופעה. מחקרים הראו שסוג המִמְרָץ (adjuvant), החומר שמוסיפים לתרכיב החיסון כדי להגביר את יעילותו, הוא גורם חשוב בשאלת הופעתה של ADE בעקבות החיסון, וכך גם אופן ההמתה (אינאקטיבציה) של הנגיף בחיסון.
בהמשך הוצעו פתרונות, ואף הושלמו מחקרים על קופי רזוס וקופי מקוק שהראו כי תופעת ה-ADE אינה מתרחשת אצלם בעקבות החיסון. בסופו של דבר נראה שפיתוח החיסונים נגד סארס ומֶרס לא נעצר בגלל חשש מ-ADE, אלא עקב היעדר עניין והשקעה בהם מצד חברות התרופות, עם דעיכת האיום ממחלות אלה, כשמחלת הסארס נעלמה והתברר שמֶרס לא מידבקת כמעט מאדם לאדם.
עם תחילת פיתוח החיסונים נגד SARS-CoV-2 ראו החוקרים בניסויים רמות גבוהות של נוגדנים מנטרלים. על פי מה שנלמד במהלך פיתוח החיסונים נגד סארס, נראה היה שיש סיכוי גבוה להצלחה וסיכון נמוך ל-ADE. החיסונים של מודרנה ושל פייזר אמנם פועלים על אותו מנגנון של ייצור נוגדנים מנטרלים כלפי חלבון הספייק, אך הם משתמשים בטכנולוגיית RNA שאינה דורשת כלל ממרץ. העובדה הזאת מקטינה עוד יותר את הסיכון ל-ADE שהתעורר בחלק מניסויי החיסונים הפוטנציאליים נגד סארס.
4 צפייה בגלריה


אילו הייתה ADE במחלת הקורונה, היינו מצפים לראות אותה אצל אנשים שנדבקו בנגיף בפעם השנייה ולא רק בחיסון, אולם תופעה כזאת לא נצפתה עד כה
(צילום: shutterstock)
התופעה והחיסון לקורונה
תופעת ה-ADE תלויה כאמור במנגנון המחלה, ולא בחיסון. אילו הייתה ADE במחלת הקורונה, היינו מצפים לראות אותה אצל אנשים שנדבקו בנגיף בפעם השנייה ולא רק בחיסון, אולם תופעה כזאת לא נצפתה עד כה באופן מובהק.
אפשר גם היה לצפות שמתן קוקטיילים של נוגדנים נגד SARS-CoV-2 יעורר אותה סערה של ADE. בפועל, מחקרים טרום-קליניים הראו שהנוגדנים הגנו על עכברים ואוגרים סוריים, בלי שנראתה החמרה בזיהום או במחלה, וגם טיפולים בחולי קורונה ששילבו קבלת נוגדנים ממחלימים (טיפולי פלזמה) הצביעו על בטיחות גבוהה ואף שיפרו את מצב החולים.
למרות הסימנים המוקדמים שהעידו כי אין ADE במחלת הקורונה, החשש מהתופעה קיים תמיד כשמפתחים חיסון חדש, וחיסוני הקורונה הנוכחיים לא יצאו מהכלל. על כן, במהלך פיתוח החיסונים נערכו בדיקות, מחקרים וניסויים רבים לבדיקת האפשרות להגברה תלוית נוגדנים, התנהל דיון אקדמי מקיף ומאמרים לא מעטים עסקו בעניין, כמו זה שפורסם ב-PNAS באפריל, ב-Science במאי, או סקירות מקיפות ב-Nature ביולי ובספטמבר.
הנושא נבדק שוב ושוב במהלך השלבים הטרום-קליניים והקליניים של פיתוח החיסונים. בחודש מארס 2020 אף התכנסה ועידה מדעית גדולה בהשתתפות מומחים בתחום מכל העולם, בהובלת CEPI (או Coalition for Epidemic Preparedness Innovations) שעסקה בלעדית בנושא בטיחות חיסוני הקורונה בהקשר של ADE.
בניסויים שנעשו על עכברים, חולדות וקופים, ובהם חיסון בנגיף מומת, לא נראו סימנים ל-ADE, אף שלהלכה בחיסון מומת אמור להיות הסיכון הגבוה ביותר לתופעה הזאת מכיוון שהוא מעורר יצירת נוגדנים לחלבונים רבים של הנגיף, ולא רק לחלבון הספייק כמו בחיסונים של מודרנה ופייזר. כך הוא פותח טווח אפשרויות רחב יותר לייצור נוגדנים לא מנטרלים.
באישור החירום שמינהל המזון והתרופות בארצות הברית (FDA) העניק לחיסון של פייזר, יש התייחסות מפורשת ל-ADE (עמוד 49): "הנתונים שנאספו עד כה לא מצביעים על סיכון להגברה תלוית נוגדנים. נהפוך הוא, הם מצביעים על יעילות במניעת מחלה חמורה בטווח הזמן שנבדק. עם זאת, מידת הסיכון להגברה תלוית נוגדנים עם הזמן, שאולי תלויה בדעיכת הכיסוי החיסוני, עדיין אינה ידועה, ויש להמשיך להעריך אותה בניסוים הקליניים ובתצפיות המשך".
כלומר, נכון להיום לא רק שלא נראתה תופעה כזאת, אלא שהנתונים שנאספו עד כה מעידים שהיא אינה קיימת. אבל רשויות הבקרה ממשיכות לעקוב לאורך זמן כדי לוודא שלא יהיו הפתעות בלתי צפויות.
ככל שיתפשטו זנים חדשים של הנגיף, נוכל לבחון אם מבחינים במקרים של ADE בהדבקות חוזרות בזנים שונים. ממצאים ראשוניים הנוגעים לווריאנט הבריטי של הקורונה, למשל, הראו שאין כנראה תופעה כזאת אצל הנדבקים בו
השורה התחתונה
ADE היא תופעה שמאפיינת מחלות נגיפיות מסוימות, שבהן הדבקה חוזרת גורמת לעיתים למחלה להופיע בצורה קשה יותר. היה חשש כי התופעה הזאת תתרחש גם במחלת COVID-19, לכן מומחים רבים חקרו את הנושא.
עד כה התופעה לא נראתה אצל בני אדם, לא נמצאה באופן מובהק בהדבקות חוזרות במחלה עצמה, לא בטיפולי פלזמה שניתנו למחלימים, לא בניסויי שלב 3 של החיסונים על עשרות אלפי אנשים, ולא במבצעי החיסון העצומים. ממשיכים כמובן לעקוב אחר החולים, המחלימים והמתחסנים, ועושים ניסויים נוספים בבעלי חיים כדי לוודא שלא ניתקל בהפתעות בלתי צפויות.
חשוב לזכור כי COVID-19 היא מחלה חדשה. ככל שיתפשטו זנים חדשים של הנגיף, נוכל לבחון אם מבחינים במקרים של ADE בהדבקות חוזרות בזנים שונים. ממצאים ראשוניים הנוגעים לווריאנט הבריטי של הקורונה, למשל, הראו שאין כנראה תופעה כזאת אצל הנדבקים בו.
אי אפשר לקבוע בצורה חד משמעית שהסיכון ל-ADE אינו קיים כלל, אבל נכון להיום הממצאים שבידינו שוללים את זה, והסיכוי לכך קלוש. הסיכון מהמחלה עצמה והנזק שהיא עשויה לגרום גם למי שאינו באוכלוסיית הסיכון, לעומת זאת, תועדו באין ספור מחקרים.
- עמית בנימין היא דוקטורנטית ממכון ויצמן למדע וכתבת באתר מכון דוידסון. קולו אור הוא כתב באתר מכון דוידסון