נשיקת מוות מולקולרית
מה זה "יוביקיטין", איך חלבונים עוברים פירוק דרך תאים, ובמילים אחרות - על מה בדיוק קיבלו הישראלים אברהם הרשקו ואהרון צ'חנובר פרס נובל בכימיה?
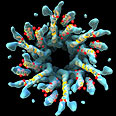
זוכי פרס נובל בכימיה, הישראלים אברהם הרשקו ואהרון צ'חנובר והאמריקני ארווין רוז, חשפו את הדרך בה חלבונים נהרסים בתוך תאים, וחשפו את המנגנון שמאחורי "נשיקת מוות מולקולרית", תווית המסמנת חלבונים המיועדים להריסה. הם חקרו משנות ה-80 את הדרך בה חלבונים עוברים פירוק בתוך תאים. עבודתם עוררה רעיונות חדשים על הדרך בה תאים מוסתים את עצמם והובילה לכיוונים חדשים בנסיונות לטיפול בסרטן.
מולקולת היוביקיטין
בשני מאמרים חלוציים, אשר פורסמו בשנת 1980, השלישיה הראתה שחלבונים אשר נבחנים להריסה משום שהם שגויים, עוברים קודם כל סימון ע"י תווית מולקולרית, עם מולקולה המכונה "יוביקיטין" (ubiquitin). המולקולה זוהתה לראשונה בשנת 1975 ומצויה בחלקים רבים בגוף.
היא כה נפוצה עד כדי כך ששמה נגזר מעובדה זו (המילה הלטינית ל"כל מקום"), אולם הפונקציה של המולקולה הנפוצה כל כך לא היתה ידועה. ביוכימאים יודעים כיום שחלבונים מסומנים עם מספר תוויות של מולקולות יוביקיטין לפני שהן מועברות לפרוטאזום, מבנה דמוי חבית, אשר בו המולקולות נחתכות לאבני הבניין שמהן הן עשויות ועוברות מיחזור.
השומר המשגיח על הגנום
התוצאות של מחקר זה הולידו אין ספור פרוייקטים מחקריים. חוקרי סרטן, למשל, למדו לאחר מכן שיוביקיטין מווסת את רמות החלבון p53, המכונה "השומר המשגיח על הגנום", משום תפקידו החשוב בהגנה מפני סרטן. ריכוזים של p53 עלו מאד כאשר תא סובל מנזק בדנ"א, וכך גרמו להפעלת שרשרת פעולות אשר עצרה את חלוקת התא בזמן שמערכות תיקון הדנ"א פעלו לתיקון הנזקים.
בהמשך לעבודה הראשונית שחשפה את תפקיד היוביקיטין כתווית מולקולרית להרס חלבונים, חוקרים אחרים הראו שרמות p53 עולות משום שיוביקיטין מפסיק להקשר אליו, ובכך מונע ממנו להגיע לפרוטאזום. עבודות מסוג זה עוררו השראה גם בחברות התרופות, ורבות מהן מפתחות כעת תרופות המכוונות למערכת היוביקיטין.
פעלו בניגוד לזרם
אינהיביציה (עיכוב) של הפרוטאזום יכולה, לדוגמה, למנוע הרס של חלבונים אנטי-סרטניים, הרס שנובע מתהליכי מיחזור נורמליים בתא. תרופה אחת שפועלת בכיוון זה, ולקייד Velcade, כעת מותרת לשימוש במספר סוגי סרטן.
חלבונים למעשה בונים את כל הדברים החיים: צמחים, בעלי חיים ובינהם גם אנו, בני האדם. בעשרות השנים האחרונות הביוכימיה עברה דרך ארוכה לעבר הסבר כיצד התא מייצר את כל חלבוניו השונים. אולם לגבי פירוק חלבונים- לגבי נושא זה לא היה עניין רב בקרב הקהילייה המדעית. צ'חנובר, הרשקו ורוז פעלו בניגוד לזרם ובתחילת שנות ה-80 גילו את מהתהליכים התאיים המחזוריים החשובים ביותר- רגולציה (ויסות) על פירוק חלבונים.
התא כתחנת בדיקה יעילה
הם גרמו לנו להבין שהתא פועל כתחנת בדיקה מאד יעילה, בה חלובנים נבנים ומפורקים בקצב מהיר מאד. הפירוק לא מתבצע אקראית, ללא אבחנה, אלא דרך תהליך המבוקר לפרטי פרטים, כך שהחלבונים שאמורים לעבור בפירוק בכל רגע נתון מסומנים מולקולרית, מעין "נשיקת מוות". החלבונים המסומנים מועברים לפרוטאזומים, אותם "פחי מיחזור תאיים", שם נחתכים החלבונים לחתיכות קטנות.
הסימון נעשה עם מולקולה המכונה יוביקיטין. היוביקיטין מוצמד לחלבון המיועד לפירוק, ומלווה אותו לפרוטאזום, שם הוא (היוביקיטין) מזוהה, כמו מפתח ומנעול, ומסמן שהחלבון אליו הוא מצורף מיועד לפירוק. מעט לפני שהחלבון נדחס לתוך הפרוטאוזום, תגית היוביקיטין שלו מופרדת ממנו ופנוייה לשימוש חוזר, לסימון חלבון אחר המיועד להריסה.
אפשרות לפיתוח תרופות חשובות
תודות לעבודתם כיום אפשר להבין ברמה המולקולרית איך התא מבקר מספר תהליכים מרכזיים בו ע"י פירוק חלבונים מסוימים ולא אחרים. דוגמאות לתהליכים הנשלטים ע"י פירוק חלבונים בתיווך יוביקיטין הם תהליך חלוקת התא, תיקון דנ"א, בקרת איכות של חלבונים חדשים שזה עתה נוצרו, וחלקים חשובים בהגנה החיסונית של הגוף.
כאשר הפירוק המתוכנן אינו פועל כראוי, נגרמת מחלה. סרטן צווארי וציסטיק פיברוזיס הן שתי דוגמאות לכך. הידע וההבנה של פירוק חלבונים בתיווך יוביקיטין מציע הזדמנות לפתח תרופות נגד מחלות אלה ואחרות.
הכתבה לקוחה מאתר הידען
 לפנייה לכתב/ת
לפנייה לכתב/ת