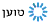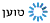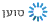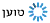נובל בכימיה על פיתוח שיטה לקביעת מבנה של חלבונים
פרס נובל לכימיה לשנת 2017 יוענק למדענים ז'ק דבושה, יואכים פרנק וריצ'רד הנדרסון על פיתוח שיטות מיקרוסקופיות לקביעת מבנה תלת מימדי של מולוקולות ביולוגיות כמו חלבונים
פרס נובל לכימיה יוענק השנה למדענים ז'ק דבושה (Dubochet) מאוניברסיטת לוזאן בשוויץ, יואכים פרנק (Frank) מאוניברסיטת קולומביה בניו יורק ולריצ'רד הנדרסון (Henderson) מאוניברסיטת קיימברידג' באנגליה על פיתוח שיטות מיקרוסקופיות לקביעת מבנה תלת מימדי של מולקולות ביולוגיות כמו חלבונים. הזוכים פיתחו שיטה לדימות (imaging) של מולקולות אלו, על ידי הקפאה מהירה ושימוש במיקרוסקופ אלקטרונים לצפות במולוקולת ברזולוציה אטומית.
עוד כתבות באתר מכון דוידסון:
האם אפשר למחזר את כל סוגי הפלסטיק?
אוריונידים, דרקונידים ותצפית על אורנוס
הכל על מדע באפליקציה של מכון דוידסון - להורדה באייפון ובאנדרואיד
בשיחה עם אחד הזוכים - יואכים פרנק הוא מסר כי: "בעשורים הראשונים מחקר על מבנים של חלבונים נעשה בעיקר בעזרת קריסטלוגרפיה של קרני X, ובשביל זה הם צריכים להיות מסודרים בצורה מאוד מסוימת, לא כולן יכולות להיות מסודרות כך. בשיטה שלנו ניתן ליצור דימות (imaging) של מולקולות שאי אפשר לדמות בצורה אחרת, וגם לראות אותן בצורה בה הן נמצאות בטבע. ברפואה אנחנו לא מסתכלים יותר על איברים, אלא על תהליכים בתא. ככה היא הפכה לרבת עצמה כל כך, אנחנו יכולים להגיע לפרטים קטנים כל כך, אנחנו יכולים להבין איך הריבוזום מבדיל בין צירוף נכון ולא נכון של נוקליאוטידים".
כבר למעלה משישים שנה מדענים ברחבי העולם משקיעים מאמצים רבים בנסיון לפענח את המבנים של מולקולות ביולוגיות כמו חלבונים ו-DNA. האתגר הגדול במשימה זו נובע מכך שהגודל האופייני לחלבון למשל, הוא כמה ננומטרים בודדים- מליונית המילימטר. בעזרת שימוש במיקרוסקופ אופטי רגיל לא ניתן לראות מבנים בגודל כזה.
קיימות שיטות שמאפשרות דימות של מבנים כמו חלבונים, כמו למשל קריסטלוגרפיה או תהודה מגנטית גרעינית (NMR) אך יש להן מגבלות רבות: הן דורשות שהמולקולות יהיו מסודרות במבנה אחיד, ויש חלבונים שקשה מאוד או אפילו בלתי אפשרי לגרום להם להסתדר במבנה כזה. כמו כן, כאשר החלבונים מסודרים כך הם אינם במצב הטבעי שלהם, והמבנה המפוענח עלול להיות שונה מזה שבו החלבונים נמצאים באופן רגיל בגוף. זה מה שגרם לריצ'ארד הנדרסון לזנוח את הקריסטלוגרפיה בשנות ה-70', ולנסות לפתח שיטה אחרת לפענוח המבנה האטומי של מולקולות ביולוגיות.
ניסיונות ראשונים לפענח מבני חלבונים
ריצ'ארד הנדרסון השלים את הדוקטורט שלו באוניברסיטת קיימברידג', והתמחה בפענוח מבני חלבונים בעזרת קריסטלוגרפיה. אולם כאשר ניסה להשתמש בשיטה זו כדי לפתור מבנה של חלבונים הנמצאים בממברנת התא הוא נתקל בקשיים. בשונה מחלבונים שנמצאים בנוזל התא (ציטופלסמה) המוקפים בעיקר במים, חלבונים הנמצאים בממברנת התא מוקפים בסביבה שומנית. לכן, כאשר הנדרסן ניסה לקחת חלבוני ממברנה וליצור מהם גבישים בתוך תמיסה מימית הוא נכשל.
מיקרוסקופ אלקטרונים היה בעקרון כלי מתאים לצורך זה. אורך הגל של אלומת האלקרונים שהוא מפיק מספיק קצר, כך שתיאורטית ניתן היה לקבל ממנו מידע על מיקומם של אטומים בחלבון. אולם באותה תקופה העוצמה של אלומת האלקטרונים היתה כה גבוהה, שאם היתה פוגעת בחלבון, היא היתה הורסת לו את המבנה לחלוטין. בנוסף, מיקרוסקופ אלקטרונים פועל בריק, אשר הוא כשלעצמו יכול להרוס את המבנה של החלבון. חלבון הממברנה שאותו הנדרסן חקר, בקטריורודופסין, התאים במיוחד להתגבר על בעיה זו. הנדרסון הבין כי אם במקום להקרין אלומה בעצמה מלאה על הדוגמא הוא ישתמש בעצמה נמוכה יותר, הוא יוכל לשמר את המבנה של החלבון. העובדה כי בקטריורודופסין מסודר באופן טבעי במחזריות קבועה בתוך הממברנה אפשרה להנדרסן לאסוף הרבה "תמונות" בעצמה נמוכה, במקום תמונה אחת בעצמה גבוהה. כך הוא הצליח ל"צלם" את המבנה של החלבון בעזרת מיקרוסקופ אלקרונים, בלי לפגוע במבנה שלו. כדי להתמודד עם בעיית הריק הנדרסן חיפה את החלבון בשכבה של גלוקוז, וכך מנע מהמים שבסביבת החלבון להתאדות.
במשך השנים הנדרסון שכלל את השיטה, ובשנת 1990 פרסם לראשונה מבנה תלת מימדי ברזולוציה אטומית של חלבון שפוענח בעזרת מיקרוסקופ אלקטרונים.
השיטה של הנדרסון הועילה לפענוח המבנים של לחלבונים שסביבתם הטבעית היתה ממברנה, ושהיו מסודרים בצורה מחזורית באופן טבעי. אך רוב החלבונים נמצאים בנוזל התא, ואין להם סידור קבוע בסביבתם הטבעית.
לנפח את המשטח
כאשר מאירים תמיסה עם חלבונים המסודרים באקראי באלומת אלקטרונים, התמונה שמתקבלת היא אוסף של תמונות דו מימדיות, אשר כל אחת מגיעה מחלבון בעל סידור שונה במרחב. בשנת 1975 פרסם יואכים פרנק תיאוריה אשר קיווה שתאפשר לקבל מבנים תלת מימדיים גם מהתמונות הדו מימדיות של חלבונים בעלי סידור אקראי. הוא פיתח תוכנת מחשב שמזהה תמונות דו מימדיות דומות, ובאופן זה ממיינת לקבוצות בודדות אלפי תמונות שונות. כך בכל קבוצה יש מידע המגיע ממספר רב של תמונות בעלות סידור מרחבי זהה, מה שמאפשר להגביר את עצמת האות שיוצר את התמונה, בדומה לאופן שבו הנדרסון הגביר את עצמת האות כשפענח את המבנה של חלבון הממברנה שלו. בהמשך פרנק הראה איך אפשר להרכיב מאוסף התמונות הדו מימדיות תמונה תלת מימדית, ובשנת 1980 פרסם מבנה של פני השטח של הריבוזום, בהתבסס על השיטות שפיתח.
מי זכוכית
כדי להתגבר על בעיית אידוי המים בריק הנחוץ לשימוש במיקרוסקופ אלקטרונים, הנדרסון השתמש בגלוקוז. אולם, עבור חלבונים שסביבתם הטבעית היא מים פתרון זה בעייתי. בשנות השבעים מדענים בקיימברידג' ניסו לפתור את הבעיה על ידי הקפאת החלבונים, מכיוון שקרח מתאדה לאט יותר ממים. אולם, השימוש בקרח "רגיל" הוא בעייתי. כאשר מולקולת מים קופאות לאט, הן מסתדרות בצורה גבישית מאוד מוגדרת. הסידור הגבישי של המים יכול לפגוע במבנה של החלבון שנמצא בתמסיה המיימית, וגם לפגוע במידע שניתן לקבל משימוש באלומת אלקטרונים. כדי להתגבר על בעיה זו, בשנת 1982 פיתח ז'ק דבושה שיטה להקפיא את הדוגמאות בצורה מהירה בעזרת אתאן וחנקן נוזלי, כך שהמים אמנם יקפאו, אך הם לא יהיו מסודרים בתור גבישים. המים הקופאים בצורה זו מכונים "זכוכיתיים". בהמשך, מדענים במעבדה של דבושה פיתחו שיטה פשוטה להכנת דוגמאות ביולוגיות לדימות בעזרת מיקרוסקופ אלקטרונים. הם פזרו את התמיסה שמכילה חלבון על אריג מתכתי (Mesh) דק, והקפיאו אותה במהירות. פשטותה של שיטת ההכנה סללה את הדרך להפצת השיטה למעבדות מחקר רבות נוספות.
מהפכת הרזולוציה
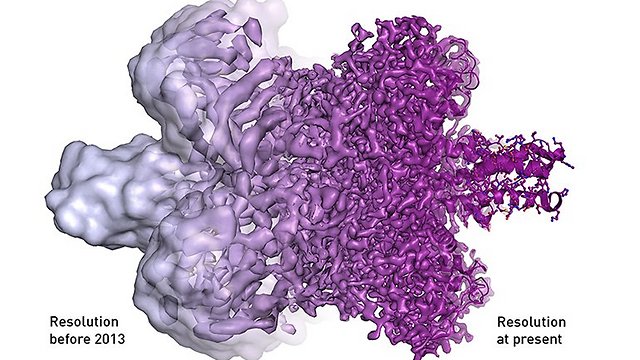
למרות ההתפחויות הרבות במהלך השנים, הרזולוציה שניתן להגיע אליה בעזרת מיקרוסקופ אלקטרונים עדיין לא הייתה גבוהה דיה.העבודה של הנדרסון אמנם הגיע לרמת פירוט של 7 אנגסטרם, אך הפרסום של פרנק למשל, על פני השטח של הריבוזום, סיפקו מידע רק עד 40 אנגסטרם. כדי לקבל מידע על מיקומם של אטומים בודדים אנו זקוקים לרזולוציה של קרוב לשלושה אנגסטרם. זה מה שהשיטה היתה צריכה כדי להוות אלטרנטיבה לNMR וקריסטלוגרפיה בעזרת קרני רנטגן.
פריצת הדרך המשמעותית הגיעה בשנת 2013, כאשר נכנס לשימוש חיישן אלקטרונים רגיש ביותר, שאפשר לקבל הרבה יותר מידע מכל מדידה. מאז 2013, מעל כל במה אפשרית הדנה במבנים של חלבונים, מדברים על "מהפכת הרזולוציה". לשם המחשה, עד שנת 2013, היו רק מבנים בודדים של חלבונים שפוענחו בעזרת קריו מיקרוסקופ אלקטרונים. כיום, כבר מדווחים כמה מאות מבנים של חלבונים ברמת פירוט אטומית.
שילוב של כמה גורמים מוביל לכך שמהפכת הרזולוציה משנה בימים אלו ממש את פניה של הביוכימיה. שיטת ההקפאה הפשוטה של דבושה מאפשרת לפענח מבנים של מולקולות גדולות כמו וירוסים וריבוזומים, אשר לא ניתן היה לפענח את המבנה שלהן בעזרת קריסטלוגרפיה וNMR. למשל, כאשר עדה יונת פתרה את המבנה של הריבוזום בעזרת קריסטלוגרפיה, היא היתה צריכה להרכיב את הפאזל חלק אחר חלק, תוך עבודה סיזיפית של עשרות שנים. כיום, במעבדה שלה מפענחים ברמה אטומית מבנים של ריבוזומים שלמים מטפילים כמו לשמניה, הנמצא בגופם של יתושים הגורמים לשושנת יריחו, בעזרת קריו מיקרוסקופ אלקטרונים. שימוש בשיטות קודמות עבור ריבוזומים ייחודיים אלו היה במעט בלתי אפשרי, מכיוון שהפקת הריבוזומים מהטפילים לא היתה שורדת את תהליך הגיבוש. בנוסף, בעזרת קריו מיקרוסקופ אלקטרונים ניתן לפענח ביתר קלות את המבנים של חלבוני ממברנה, קבוצת חלבונים בעלת חשיבות מרובה, המהווה מטרה נפוצה לתרופות שונות. לכן, השימוש בקריו EM, סולל את הדרך לפענוח המבנה של חלבונים ומולקולות ביולוגיות אחרות, אשר עד לאחרונה היו פשוט בתי נראות.
אחרי שיואכים פרנק הציג את השיטה שלו לעיבוד התמונות ממיקרוסקופ אלקרונים בשנת 1975, אחד מעמיתיו כתב: " אם שיטות אלו יהיו מושלמות, השמים יהיו הגבול".
לביא ביגמן דוקטורנט במכון ויצמן למדע וכתב באתר מכון דוידסון