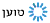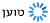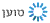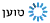החץ המורעל של החיידק הזהוב
צוות חוקרים מהפקולטה לביולוגיה בטכניון פענח מבנה חדש של חלבון שלא היה ידוע עד כה. המאמר המתפרסם בכתב העת המדעי היוקרתי Science חושף לראשונה סיב עמילואידי שבעזרתו תוקף החיידק האלים "סטפילוקוק זהוב" את תאי האורגניזם ואת מערכת החיסון שלו
סטפילוקוק זהוב, אחד החיידקים האלימים הידועים כיום, תוקף את התאים ואת מערכת החיסון של האורגניזם המאחסן, וזאת בין השאר באמצעות סיבים ייחודיים שהוא מפריש. כך עולה ממחקר שהובילה פרופ'-משנה מיטל לנדאו מהפקולטה לביולוגיה בטכניון. להערכתה צפוי הגילוי להוביל לפיתוח אנטיביוטיקה ייעודית שתפגע בסיב וכך תאפשר לתאי מערכת החיסון להתמודד עם החיידק ביעילות.
המחקר המתפרסם הערב (יום ה') בכתב העת Science התבצע על-ידי חוקרים במעבדת לנדאו: הדוקטורנטית עינב טייב-פליגלמן, מנהלת המעבדה ד"ר אורלי טבצ'ניקוב, אשר משה וד"ר אורית גולדשמידט-טרן. לעבודה תרמו גם חוקרים ממאיץ החלקיקים בגרנובל (צרפת) ומאוניברסיטת קליפורניה לוס אנג'לס (UCLA).
סטפילוקוק זהוב הוא חיידק תוקפני במיוחד שהתגלה בסוף המאה ה-19 בסקוטלנד ושימש את אלכסנדר פלמינג בתרבית המפורסמת שבה התגלה הפניצילין. חיידק זה עמיד לזנים רבים של אנטיביוטיקה ואחראי לחלק ממקרי ההדבקה המתרחשים בבתי חולים ובקהילה. שמו הלטיני, Staphylococcus aureus (אשכול ענבים זהוב), נובע מצורתו המזכירה אשכול.
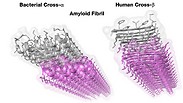
במאמר, המציג לראשונה גם מבנה גבישי ראשון מסוגו ברזולוציה אטומית, נחשף כלי נשק המסייע לחיידק: סיב עמילואידי מסוג שלא היה ידוע עד כה. עמילואידים, חלבונים הידועים לשמצה בשל קישורם למחלות נוירו-דגנרטיביות כגון אלצהיימר ופרקינסון, יוצרים סיבים חלבוניים - מעין קורי עכביש - המאופיינים במבנה מסודר ויציב מאוד. יציבות זו מאפשרת להם להחזיק מעמד בתנאים קיצוניים שחלבונים רגילים לא שורדים בהם, ואחת הדוגמאות המפורסמות לכך היא מגפת "הפרה המשוגעת" שפרצה בבריטניה בשנת 1986.
לדברי פרופ'-משנה לנדאו, "המחלה הזאת הפתיעה את הקהילה המדעית מפני שהגורם לה לא היה וירוס ולא חיידק, אלא חלבון שנקרא פריון, בעל מבנה של עמילואיד. פתאום התברר שגם חלבון יכול לעבור בין אורגניזמים, ובשל יציבותו הוא הדביק בני אדם דרך אכילת בשר נגוע - כלומר לא התפרק בשלבים של עיבוד הבשר, בישולו ועיכולו".
חלבון הפריון של "הפרה המשוגעת", בדומה לכל העמילואידים שהתגלו עד כה, שייך לקבוצה בעלת מבנה הקרוי cross-ß. במחקר הנוכחי התגלה עמילואיד בעל מבנה חדש לגמרי, שקיבל את השם cross-α. "ידענו שיש בידנו משהו ייחודי, אבל רק אחרי כמה נסיעות למאיצי חלקיקים בגרנובל ובשיקגו הצלחנו לאמת את היותו עמילואיד מסוג חדש. כדי לפרסם את התגלית ב-Science נדרשה עוד עבודה רבה, אבל מהרגע הראשון היה ברור לנו שמדובר בתגלית דרמטית מאוד המהווה שינוי פרדיגמה".
השלב הבא: אנטיביוטיקה ממוקדת
פרופ'-משנה לנדאו מעריכה כי הגילויים המתפרסמים כעת עשויים להוביל לפיתוח סוגי אנטיביוטיקה המבוססים על מנגנון פעולה חדש. מנגנון זה יפגע בחלבון (עמילואיד) וכך ינטרל לפחות את אחד מכלי הנשק החשובים של החיידק האלים. להערכתה, מאחר שאנטיביוטיקה זו לא תחסל את החיידק אלא רק תגדיל את פגיעותו, היא לא תוביל להתפתחות מהירה של עמידות חיידקית כלפיה.

"עמידות לאנטיביוטיקה מתפתחת בחיידקים בעקבות לחץ אבולוציוני - הברירה הטבעית מובילה להתפתחות של חיידקים שהאנטיביוטיקה לא מצליחה להרוג. אם נפחית את הלחץ על החיידק, ולא נפגע בו אלא רק בהיבטים האלימים שלו, יתכן שהעמידות לאנטיביוטיקה לא תמהר להתפתח", אמרה פרופ'-משנה לנדאו.
לגבי המשך הדרך מבהירה פרופ'-משנה לנדאו כי פיתוח תרופות נעשה בדרך כלל מחוץ לכותלי האקדמיה בשל עלותו הגבוהה של התהליך. "עם זאת, אנחנו יכולים לתת למפתחי התרופות ידע מדעי שיאיץ ויוזיל את תהליך הפיתוח. התגלית הנוכחית - פענוח המבנה של עמילואיד cross-α - מהווה קפיצת מדרגה בתהליך כזה. כעת האתגר שלנו הוא למצוא את החומר שיעכב את cross-α וכך יפרק את החיידק מנשקו. בהיבט המדעי יש כאן שיעור חשוב: חשיבה מחוץ לקופסה פותחת דלתות חדשות לעולם העמילואידים. פענוח מבנים חדשים עשוי להוביל לתובנות הקשורות גם למחלות נוירו-דגנרטיביות וגם לעמילואידים 'טובים', המשתתפים בהגנה טבעית מפני זיהומים. ממצאים אלו יאפשרו פיתוח אמצעים להגנה מפני רעלנים בחיידקים ובפטריות".
הקשר לחתן פרס נובל
פרופ'-משנה לנדאו השלימה תואר ראשון ברוקחות באוניברסיטה העברית ושני תארים באוניברסיטת תל אביב - תואר שני בנוירוביוכימיה ותואר שלישי בביואינפורמטיקה מבנית. לאחר הדוקטורט יצאה לפוסט-דוקטורט באוניברסיטת קליפורניה לוס אנג'לס (UCLA), שם התמחתה במיקרו-קריסטלוגרפיה בקרני X ובעמילואידים הקשורים במחלת אלצהיימר.
"בתום הפוסט-דוקטורט", היא אומרת, "בחרתי בטכניון בין השאר בזכות תשתיות המחקר המעולות הקיימות בו. במרכז לביולוגיה מבנית, שהוקם ביוזמתו של חתן פרס נובל לכימיה פרופ'-מחקר אהרן צ'חנובר בהשקעה של כ-5 מיליון דולר, יש תשתית מעולה ברמה עולמית שמאפשרת לפתור מבני חלבונים ברזולוציה אטומית." במהלך השנים זכתה פרופ'-משנה לנדאו במלגות ובמענקים רבים ובהם מענק מרי קירי, מענק תכנית מרכזי המצוינות בישראל ((ICORE, מלגת אלון, ומענקי הקרן הדו לאומית ישראל-ארה"ב, הקרן הלאומית למדע וקרן ישראל-גרמניה (DIP).
 לפנייה לכתב/ת
לפנייה לכתב/ת