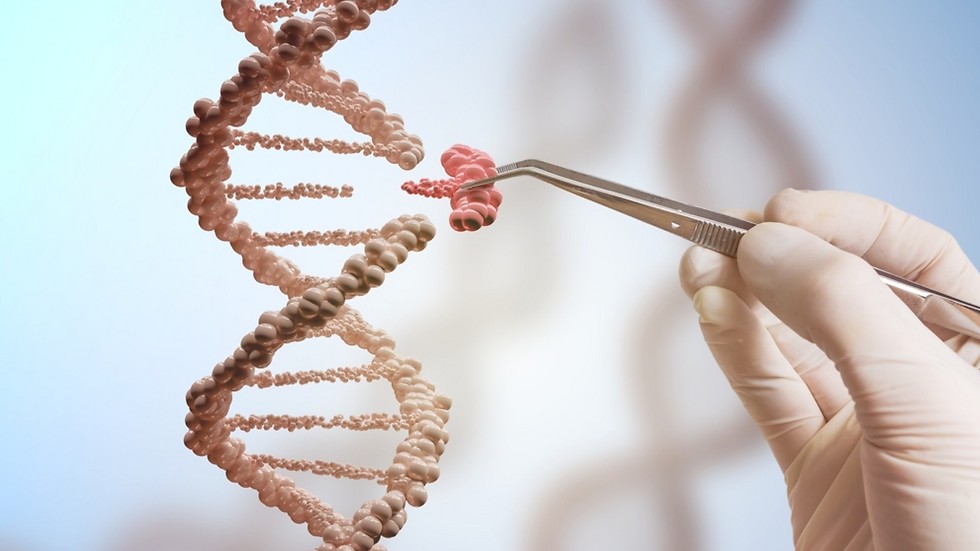
טכניקת גזירה והדבקת DNA - האם השלב הבא זה הזמנת תינוק מקטלוג?
שש שנים בלבד אחרי לידתה של "העורכת הגנטית", טכנולוגיה שמאפשרת גזירה והדבקה של מקטעי ,DNA היא כבר משמשת בשלל פיתוחים ויישומים - וזהו רק קצה הקרחון. האם בעתיד הלא רחוק נוכל להזמין ולערוך תינוק מקטלוג לנו חיית גנטי מחמד במעבדה הביתית? ואם כן, באיזו סכנה זה מעמיד אותנו?
במרץ השנה התכנסו חוקרים מתחומים שונים בפריז כדי להכריז על הקמת – ARRIGE האיגוד למחקר וחדשנות אחראיים בעריכה גנטית (Association for
Responsible Research and Innovation in Genome .(Editing האיגוד קרא למדענים, לארגוני חולים, לחברות, למקבלי החלטות וגם לאזרחים לדון בשאלה איך אפשר לקדם את טכנולוגיות העריכה הגנטית באופן בטוח?
הקמת האיגוד נבעה מההבנה שהדיון בנושא נהפך לדחוף. אם חשבתם שזה עוד אחד מהדיונים על תסריטי סוף העולם שתביא עלינו הקידמה (כמו הוויכוחים על ההתחממות הגלובלית או הצמחים המהונדסים), ושהעיסוק בסוגיה רלוונטי בעיקר לנינים שלכם (בעוד שלנו יש כמה צרות דחופות יותר לטפל בהן), הביאו בחשבון שממש לא מדובר בעתיד הרחוק. הדיון על עריכה גנטית קרוב יותר, רלוונטי יותר ומטלטל יותר מכל הדיונים האחרים.
"מצד אחד זו טכנולוגיה שטמונות בה הבטחות גדולות לשיפור העולם ולצמצום הסבל של בני אדם", אומר פרופ' נח עפרון מהחוג למדע, טכנולוגיה וחברה באוניברסיטת בר אילן וחבר בוועדה לצמחים מהונדסים. "אך מהצד השני מדובר בטכנולוגיות מסוכנות, והסכנות שהן עלולות להוליד אינן באיזה עתיד היפותטי רחוק טווח. מעצם טבען יש ביכולתן של טכנולוגיות לתיקון הגנים לייצר שינוי בגנום, שינוי שיועבר הלאה בתורשה ועלול לגרום לאסון אקולוגי או אנושי. אפילו בעת עריכת ניסוי הן עשויות לחולל שינוי בבני אדם או בבעלי חיים, שינוי שלא התכוונו אליו אבל שיצא משליטתנו, ולא תהיה לנו יכולת לבטל אותו ולהחזיר את המצב לקדמותו".
ולמה יש לשבת מהר לדיון ולהחליט בשאלות כמו: מה מותר ומה אסור? מה בין ריפוי של מחלה ובין יצירת זן חדש (ומי יודע אם משופר) של צמח, בעל חיים או אולי של המין האנושי? מה בגדר פיתוח תרופה ומה יוביל לחלום בלהות? מכיוון שהחוקרים, המפתחים, הרופאים והחברות המסחריות לא מחכים בשקט עד שנחליט, בשש השנים שחלפו מאז שהתגלתה הטכנולוגיה היעילה והקלה לעריכה גנטית (הנקראת CRISPR-Cas9) הניסויים, הפיתוחים והיישומים שלה הולכים ומתרבים במהירות.
כולם גוזרים ומדביקים
כאמור, התקוות מהטכנולוגיה גדולות. ההבטחה שיום אחד יתאפשר לנו לגשת ישירות למקור הקלקול, לסיבת החולי או למוטציה ב-,DNA לגזור אותם ופשוט להדביק במקומם מקטע גן תקין נדמית כגרסה המדעית לפנטזיה. מאחר שכבר רחקנו מעולם האגדות ואנו כותבים (וחושבים) במעבד התמלילים ,WORD זכתה המערכת לתיקון גנים לשם "עורכת גנטית".
הכינוי "עורכת" נובע לא רק מעולם האסוציאציות העכשווי שלנו, אלא גם מהעובדה שתהליך התיקון כרוך בגזירה (Cut) של מקטע מקולקל והעתקה (Paste) של מקטע תקין. "מערכת ה-CRISPR-Cas9 מבוססת על חיקוי של מערכת שהתגלתה בחיידקים ומשמשת אותם כדי להתגונן מפני נגיפים", מסביר ד"ר איגור אוליצקי, חוקר במחלקה לבקרה ביולוגית במכון ויצמן.
"החיידקים משתמשים באנזים כדי לחתוך את ה-DNA של הנגיף ולהרוס אותו. לאורך הדרך הם שומרים מקטעי DNA מהנגיף וכך הם יודעים לזהות אותו בפעם הבאה ולגזור אותו במדויק. לפני שש שנים התגלה שאפשר ליישם את המערכת הזאת גם על תאים אנושיים ואף לתכנת אותה לגזור קטעים ספציפיים. זו הקריספר".
המערכת המהונדסת הוצגה לעולם בשלהי 2012 ומאז פשטה כאש בשדה חוקרים. כולם גוזרים ומדביקים, ושיחת המדענים כיום עשויה להזכיר מהצד שיעור מלאכה. עד כה הספיקה העורכת לגזור את המוטציות שגורמות לפטריות חתוכות להשחיר, את אלה שגורמות לתפוחי אדמה להרקיב, לסייע ביצירת זן של יתושי מלריה שיכחיד את עצמו, להפוך חיידקי אי-קולי לחיידקים בצבע ארגמן, לגזור מוטציה לX- שביר בעכברים ואף לאבחן מחלות באמצעות גזירת מוטציות המאפיינות אותן.
האם היא מתקרבת בצעדי ענק לגזירת מוטציות באנשים ולסייע בריפוי מחלות? אף על פי שבחצי השנה האחרונה רשמה הקריספר גם כמה אכזבות, הרי שההתקדמות שחלה בשש השנים מאז יציאתה עושה רושם שכן. שלל פרסומים בספרות המדעית וסטארט-אפים השוקדים במרץ על פיתוח תרופות, מספקים סימנים שבעתיד הלא רחוק נוכל לגשת לרופא לא כדי לקבל מרשם לתרופה אלא כדי שישכתב את המרשם המקודד לגופנו. או לפחות עבור מחלות שהמנגנון שלהן מותאם למה שביכולתה של המערכת לעשות.
לצאת מהבועה החולה
"המחלות שיש תקווה כי המערכת תסייע במציאת תרופה עבורן הן בעיקר מחלות של מערכת הדם והחיסון, מחלות גנטיות המביאות לעיוורון, מחלות מטבוליות, מחלות שרירים, מחלות נוירולוגיות וסרטן", ממפה ד"ר איל הנדל, ראש המעבדה לעריכה גנטית במכון הננוטכנולוגיה באוניברסיטת בר אילן, את שדה הקריספר. הנדל עשה את הפוסט דוקטורט שלו במעבדה בסטנפורד, שבה צפוי להתחיל ניסוי בחולים עם מחלת דם בשם אנמיה חרמשית כבר בשנה הבאה. כיום הוא עצמו שוקד, בשיתוף עם רופא הילדים פרופ' רז סומך מתל השומר, על פיתוח טיפול למחלת "ילדי הבועה".
ילדי הבועה הם דוגמה טובה לחולים שהיכולת לערוך את הגן עבורם, אם תצליח, תאפשר ריפוי של המחלה. מדובר בכשל חיסוני משולב חמור, מחלה שגורמת לכך שהלוקים בה אינם מפתחים מערכת חיסונית ועלולים ללקות בזיהומים מסכני חיים. מקור הכינוי למחלה הוא המקרה המפורסם של דיוויד ווטר, ילד שנולד בטקסס בשנות ה-70 של המאה הקודמת, שכדי לשרוד למרות הכשל החיסוני, נאלץ לשהות עד גיל 12 בתוך בועה הרמטית שממנה לא יצא מעולם.
השתלת מוח העצם שהייתה אמורה להציל אותו גרמה לבסוף למותו למרבה הצער. כיום אפשר לרפא את המחלה על ידי השתלת מח עצם, אך לא בכל המקרים אפשר למצוא תורם מתאים, וכאן נכנסת אפשרות התיקון. מדובר במחלה שהמוטציה הגנטית שגורמת לה מוכרת, ולכן אפשר לנווט אליה את הקריספר כדי לתקן את הגן הפגום.
ד"ר הנדל סבור שבמקרה של המחלה הזאת בהחלט יש תקווה למצוא תיקון גנטי. "היות שהתיקון הגנטי מתבצע רק בתאים שאליהם הגיעה העורכת ובתאים שמשתכפלים מהם, עריכה אינה יכולה כיום לסייע במחלות שבהן יש להביא לתיקון של כל תא מתאי הגוף", הוא מסביר. "אבל במחלת הבועה אין צורך בכך. די בתיקון של חלק מתאי הדם כדי שתיווצר מערכת חיסונית תקינה שתשפר את מצבם של ילדי הבועה". לדברי ד"ר אוליצקי, גם "מחלות דם כמו המופיליה, אנמיה חרמשית ובתא תליסמיה מותאמות לתיקוני עריכה, מכיוון שאפשר להוציא תאי דם מהגוף, לשנות אותם במעבדה ולהחזיר את התאים המתוקנים לגוף, זאת בניגוד לשרירים או לאיברים מורכבים כמו המוח".
תיקון מוטציה או שיבוש הגנום
עם זאת, היומרות אינן מוגבלות לטיפול במחלות האלה. יש מי שעובד גם על גרסאות שיאפשרו לעורכת הגנטית לתקן כל תא ותא בגוף. אלא שההשלכות של תיקון כזה שונות,וכאן לצד ההבטחות מתרבים החששות. מתברר, שיש דרך לגרום ל"עורכת" להיות רלוונטית גם למחלות שבהן יש צורך לתקן את כל התאים בגופו של אדם ולהעלים את כל המוטציות מהגוף. כדי לעשות זאת יש צורך לערוך תאים שמהם ישתכפלו כל יתר התאים בגוף, כלומר להחדיר את הקריספר לתא זרע וביצית או לתא שנוצר כשהם מתלכדים ליצירת עובר. אם עורכים את התאים האלה, שמהם נוצרים כל התאים בגוף, העובר שיתפתח יהיה "מתוקן".
ניסוי פורץ דרך מסוג זה, שבו "ערכו" עובר אנושי, תואר במאמר בכתב העת המוביל למחקר Nature בשנה שעברה. בניגוד לניסויים קודמים, בניסוי הזה הצליחו החוקרים לתקן מוטציה האופיינית למחלה גנטית שכיחה לא בתאים ולא בעכברים אלא בעובר אנושי. מדובר במוטציה דומיננטית שכיחה יחסית הגורמת לעיבוי בשריר הלב שעשוי להביא למוות פתאומי בגיל צעיר (של אתלטים). תוצאות הניסוי נראו מבטיחות. רוב העוברים עברו עריכה מוצלחת והצליחו להיפטר מהמוטציה שגורמת למחלה.
פרופ' דלית בן-יוסף, מנהלת המעבדה להפריה חוץ גופית ומעבדות המחקר בחטיבת הפריון בבית חולים ליס, איכילוב, ובעצמה חוקרת עריכה גנטית בתאי גזע עובריים, מסבירה מדוע המחקר נחשב לפריצת דרך: "יעילות ה-CRISPR כביכול גבוהה מאוד כשמזריקים אותו לביצית ביחד עם הזרע עוד לפני יצירת העובר, והתיקון מתבצע ביחס לתבנית הDNA- התקין שנמצא בביצית. כמו כן החוקרים הראו שבשיטה זו לא התרחשו מוטציות באזורים נוספים בגנום, שזו אחת מתוצאות הלוואי של מערכת העריכה הזאת. אבל למרות ההישגים המרשימים שהוצגו במחקר, הוא לווה בביקורת רבה בקהילה המדעית בנוגע למהימנות של הממצאים".
בו זמנית הוביל הניסוי גם לעלייה ברמת החרדה מהטכנולוגיה. תיקון של מוטציות בשלבים מוקדמים של ההתפתחות העוברית משמעו "תיקון" גם של הדורות הבאים. לו היו נותנים לעוברים האלה להתפתח (בניסוי המדובר הם הושמדו), והם היו גדלים ומעמידים צאצאים, הם היו מורישים את התיקון גם לצאצאיהם. עריכה גנטית של עוברים היא זו שגורמת לנו להריץ סרטים על אנושות חדשה, אחרת, מוזרה או משובשת.
עַצב לי תינוק
הרבה מהדיון על עריכת עוברים מתמקד בסוגיית "תינוקות מעצבים" (.(Designers Babies "תינוקות מעצבים" הוא שם קוד לתסריט שבו אנשים יבחרו אילו תכונות הם רוצים שיהיו לילדיהם. אחד החששות הוא שאלה יהיו העשירים – שילדיהם יהיו נבונים, יפים ואתלטיים יותר מילדי העניים. בנוסף, יש חשש שהשבחת המין האנושי, גם אם תיעשה באופן סוציאליסטי ויהיה סבסוד להנדוס תינוקות עניים, עדיין תגרום לחוסר איזון בעולם. מדענים רבים מבטלים את התסריטים האלה במחי יד באומרם שיופי, חוזק וחוכמה הם תכונות המושפעות ממספר רב של גנים, והאפשרות שניתן יהיה לתקן כל כך הרבה גנים בו זמנית איננה נראית כיום באופק, וכך גם לא היכולת לעצב את התינוקות דשופרא האלה.
אבל למעשה "תינוקות מעצבים" הוא לא התסריט המעוות היחיד ששימוש לרעה בטכנולוגיה עלול להוליד. זהו פשוט התסריט שהדמיון המוגבל שלנו יודע לייצר. הביקורת שנמתחה על מחקר תיקון העוברים מצביעה על עוד כמה תסריטים שיכולים להתרחש עוד לפני שיוקמו כאן קליניקות לעיצוב ילדים. תסריטים שבהם מעורבים השלכות ושיבושים שאותם לא ידענו לצפות. חלק מהתקלות מחבלות בעצם היכולת להפוך את הקריספר לטיפול רפואי. אבל אחרות ייתכן שיתגלו בעתיד, אחרי שניישם בהצלחה את הטיפול ונגלה את ההשלכות שמעולם לא חשבנו עליהן.
נכון שכל הניסויים צריכים לקבל אישור של המוסדות המפקחים ושל ועדות הלסינקי, אבל הבעיה היא שהמוסדות האלה אינם מיומנים בבחינת ההשלכות של ניסויים על עתיד האנושות. ואם נגזור בטעות משהו שאנו למעשה זקוקים לו, האם נמצא אחר כך דרך להדביק אותו בחזרה? או כפי שאומר פרופ' עפרון: "אף פעם איננו יכולים לדעת בוודאות מה תהיה התוצאה של ניסוי כלשהו. קל לדמיין שנערוך ניסוי ונגרום לתוצאה מסוכנת שלא יהיה אפשר לבודד אותה, או לשינוי בצמח, חיה או בן אדם שיצא משליטתנו ולא נוכל לחזור בנו".
כך מתבצעים ניסויים בעוברים אנושיים:
(אל) תנסו את זה בבית
בין האפשרויות שהועלו בוועידה בפריז היו כאלה שישנו את הקריטריונים של הגופים המפקחים כמו ה-FDA וועדות הלסינקי. אבל יש בעיה נוספת, שמחזקת את הדרישה לדיון בטכנולוגיה, והיא שחלק מהניסויים בעריכה גנטית מתבצעים הרחק מהמעבדות ומהמוסדות האקדמיים, לעתים אפילו במוסך ובמטבח של אנשים פרטיים.
תנועת הביו-האקרז, ששמה לעצמה למטרה להנגיש את הביולוגיה לציבור הרחב ולגרום לכך שכל אחד יוכל לעסוק בביולוגיה מולקולרית, מאמצת גם היא את מספרי המוטציות. גיטה רייניץ, בעלת מאסטר בביולוגיה וממייסדות ביוהאב ישראל, מעבדה קהילתית, מסבירה: "אפשר כיום לערוך גנים בבית בעזרת ציוד שעולה פחות מ-1,000 שקל.
יש היום אפילו חברות שמוכרות ערכות קריספר זולות הביתה. המפורסמת שבהן היא ODIN שתמורת 150 דולר תשלח לכם מבחנה קטנה ובה אנזים ,CAS9 מבחנה ובה טיפת נוזלRNA (שמספק את הכתובת למספריים), וכן צנטריפוגה, פיפטה, צלחת פטרי, כפפות. הערכה הזאת מאפשרת לערוך שמרים בצלחת פטרי ולהפוך אותם לשמרים פלורסצנטיים". הערכה הזאת נראית אולי כמו משחקי "דן החקרן", אבל אנשים עם השכלה בביולוגיה יכולים בעזרת ציוד לא יקר לבצע במקומות כמו המעבדות הקהילתיות של ביוהאב ישראל עריכה משמעותית יותר של חיידקים, שמרים וצמחים.
עם זאת, היה גם מי שניסה לערוך בביתו יצורים גדולים מעט מחיידקים. דיוויד אישי ממיסיסיפי, בעל בית גידול לכלבים דלמטיים, החליט שערכת קריספר היא למעשה הציוד העדכני הנדרש למרביעי כלבים. אגב, המטרה שלו בעריכת הדלמטים לא הייתה כמו זו של קרואלה דה ויל להשביח את פרוותם, אלא להקטין את הסיכון הגבוה שלהם לאבנים בשלפוחית השתן. אולי נראה לכם שהוא בסך הכל שינה את הטכניקה להשבחת גזע, מה שעושים מגדלי כלבים גזעיים מאז ומתמיד, אבל ל-FDA זה לא נראה כך. רשויות המחקר האמריקאיות הוציאו בעקבות זאת תקנון לעיצוב חיות והורו לאישי עצמו שאסור לו למכור דלמטים ערוכים.
ערכות העריכה הביתית האלה מבהירות עוד יותר שחייבים לדבר על העורכת הגנטית, כי ברור שהדברים יכולים לצאת משליטה, ולא ברור איך נציב להם גבול. למעשה אנחנו אפילו לא יודעים בדיוק ממה לדאוג. "תינוקות מעצבים" הם אחרי הכל רק איזה שם קוד לשימוש אפשרי בטכנולוגיה. כמו הכינוי "עורכת גנטית" גם "תינוקות מעצבים" הם דרכנו לנסות להבין את הכלים של רפואת העתיד באמצעות חומרים השייכים להיום. משהו שקשור לצרכנות, לקניונים, לעושר, לעיצוב ולקסטומיזציה.
אבל השבחת תינוקות היא אולי רק בעיה היפותטית וקטנה. או כפי שאומר פרופ' עפרון: "העובדה שאין אג'נדה ברורה לאנשים שמתלהבים מהטכנולוגיה או לאלה שמודאגים ממנה. העובדה שאנחנו אפילו לא יודעים איך לחשוב עליה היא חלק מהסיבה שכל כך חשוב להתכנס ולדון על כך". כך שלמעשה נראה שאם רוצים להשתמש בטכנולוגיה הזאת צריך להתחיל מעריכת המוטציות שהופכות את הדמיון שלנו למוגבל כל כך. רק עם "דמיון מעצבים" נוכל אולי להעלות על הדעת מהם התסריטים האפשריים שאליהם הטכנולוגיה הזאת עלולה להוביל ושמהם היינו צריכים להימנע. אבל כרגע, כשהחוקרים עדיין לא מתמודדים עם עריכה של מחלות פשוטות, הדמיון שלנו נשאר מאחור, ולא נותר לנו אלא לשבור את הראש כדי לדעת איך ומי צריך לפקח על המספריים החדשים.
 לפנייה לכתב/ת
לפנייה לכתב/ת